|
Capítulo 2: Composición química de los seres vivos
Introducción Regresar
Los seres vivos estamos formados por materia, con un alto grado de organización. En la composición química de los seres vivos, más del 90% del peso de los mismos está representado tan solo por cuatro elementos, los bioelementos principales: Oxígeno, Carbono, Hidrógeno y Nitrógeno, con las contribuciones que se especifican en la siguiente tabla.
| Bioelemento |
Porcentaje del peso de los organismos |
| Oxígeno |
63% |
| Carbono |
20% |
| Hidrógeno |
9,5% |
| Nitrógeno |
3% |
Los cuatro bioelementos principales son los componentes primordiales de las sustancias orgánicas, así llamadas porque en la naturaleza se encuentran como producto de la actividad de los organismos vivos. Las sustancias orgánicas de mayor importancia en los seres vivos se agrupan en cuatro familias: los glúcidos o hidratos de carbono, los lípidos, las proteínas y los ácidos nucleicos.
Los seres vivos también contienen sustancias inorgánicas, entre ellas, la más abundante de todas, el agua, que representa alrededor del 70% del peso corporal. Además del agua, otros minerales forman en conjunto entre el 4 y el 5% del peso corporal. Los macrominerales, o minerales más abundantes, son el Calcio, el Fósforo, el Magnesio, el Sodio, el Cloro, el Potasio y el Azufre. Entre los microminerales, también llamados oligoelementos, por su pequeña proporción en el organismo, se encuentran: Hierro, Zinc, Cobre, Yodo, Fluoruro, Manganeso, Cromo, Cobalto, Selenio y Molibdeno.
| Composición química de los seres vivos |
Sustancias inorgánicas |
Agua |
| Minerales |
Macrominerales |
| Microminerales |
| Sustancias orgánicas |
Glúcidos |
| Lípidos |
Proteínas |
| Ácidos nucleicos |
Agua Regresar
El agua: puentes de hidrógeno, cohesión molecular y propiedades del agua
El agua es la sustancia más abundante en los seres vivos. Si bien es una sustancia muy común, debido a su abundancia, no es una sustancia ordinaria, pues reúne una serie de propiedades que la hacen especial y determinan el papel que desempeña en los organismos.
Las moléculas de agua (H2O) están formadas por un átomo de oxígeno ligado a dos átomos de hidrógeno, que quedan separados entre sí por un ángulo de 105º.
El agua es un compuesto polar: los enlaces entre oxígeno e hidrógeno son uniones covalentes polares. La diferencia de electronegatividad entre estos dos elementos hace que las cargas positivas y negativas no se distribuyan de manera uniforme, sino asimétricamente, formando polos o zonas de densidad eléctrica positiva y negativa. Al compartir sus electrones con el oxígeno (muy electronegativo), los dos átomos de hidrógeno dejan sus núcleos virtualmente desnudos. Dado que cada núcleo de hidrógeno es un protón, quedan así dos cargas positivas expuestas. Estas cargas positivas ejercen una fuerza de atracción sobre cualquier electrón no compartido. Como puede observarse en la representación de Lewis de la molécula de agua, el átomo de oxígeno posee dos pares de electrones no compartidos. Por lo tanto, las moléculas de agua se atraen unas a otras; los hidrógenos de una molécula se unen a los electrones desapareados de los átomos de oxígeno de otras moléculas. Cada molécula de agua presenta cuatro de estos sitios de unión, dos positivos (los núcleos de los hidrógenos) y dos negativos (los pares de electrones no compartidos del oxígeno). Es decir que una molécula de agua puede unirse de esta manera a otras cuatro.
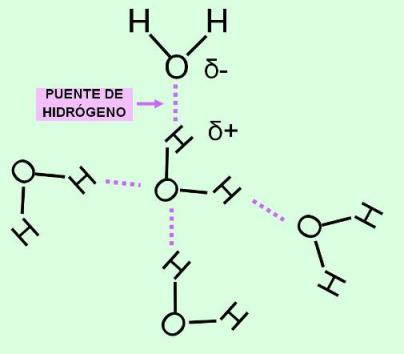 |
Las uniones así formadas son un tipo de unión intermolecular denominado unión puente de hidrógeno. Dichas uniones no ocurren solamente entre las moléculas de agua, sino que se producen entre muchos compuestos diferentes, siempre que éstos sean polares.
Las uniones puente de hidrógeno son enlaces más débiles que los enlaces interatómicos, como los covalentes o los iónicos; sin embargo, en conjunto, ejercen una influencia muy importante, tanto en las propiedades del agua como en otras sustancias que forman parte de los seres vivos.
La capacidad de las moléculas de agua para formar puentes de hidrógeno entre sí es responsable de la fuerte unión o cohesión molecular que se verifica entre ellas. La alta cohesión de las moléculas de agua explica muchas de sus propiedades, tales como: altos puntos de fusión y ebullición, flotabilidad del hielo, alto calor de vaporización, alto calor específico y alta tensión superficial.
Es sabido que el agua se presenta en estado natural en nuestro planeta, al mismo tiempo y en abundancia, en tres estados: sólido, líquido y gaseoso, mientras que otras sustancias permanecen en uno solo de estos estados (aunque en otra parte del universo, o en condiciones de laboratorio sea factible el cambio de fase).
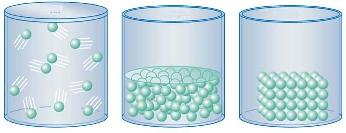 |
Recordemos que un sólido se caracteriza por su forma y volumen propios; un líquido no tiene forma propia, pero sí un volumen definido; mientras que un gas no tiene forma ni volumen propios, sino que adopta los del recipiente que lo contiene. El estado físico o de agregación depende de las fuerzas de atracción y repulsión que hay entre las partículas que forman una sustancia. Si predominan las fuerzas de atracción, el estado es sólido, si predominan las de repulsión, el estado es gaseoso y si ambos tipos de fuerza están equilibrados, el estado es líquido. |
Los estados de agregación son función de la temperatura y se suceden unos a otros a medida que la temperatura aumenta o disminuye en una sustancia dada. Si se eleva la temperatura de un sólido, hasta un determinado punto (punto de fusión) éste funde, convirtiéndose en líquido. Si se aumenta después la temperatura del líquido hasta cierto valor (punto de ebullición), entra en ebullición; más allá de este punto, la sustancia pasa al estado gaseoso. La temperatura es una medida del grado de agitación de las partículas que forman una sustancia, y por eso aumenta cuando éstas absorben calor, que es una forma de energía.
Ahora volvamos al agua. A una presión de 1 atm, su punto de fusión es de 0º C y su punto de ebullición de 100º C. Cuando se la compara con sustancias análogas, pero de mayor peso molecular, como el H2S, los valores correspondientes al agua resultan extremadamente más altos de lo esperado (los valores para el H2S son - 64º C y – 42º C, respectivamente). ¿Por qué los puntos de fusión y ebullición del agua son tan altos? Por los puentes de hidrógeno. Llevar al agua desde el estado sólido al líquido o de éste al gaseoso, requiere una gran cantidad de energía para liberar a las moléculas, ligadas entre sí por los puentes de hidrógeno. En conclusión, los puentes de hidrógeno son la causa de que el agua se encuentre en sus tres fases dentro de los límites de temperatura y presión naturales en la Tierra. De no ser por los puentes de hidrógeno se esperaría que el agua fundiera a -100º C y entrara en ebullición a -80º C, lo cual haría imposible la vida tal como la conocemos.
 |
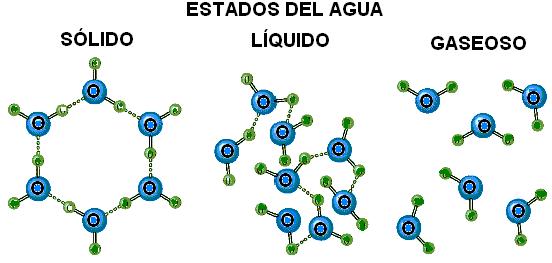
Al estado sólido, cada molécula está unida a otras cuatro mediante sendos puentes de hidrógeno, extendidos hacia cuatro direcciones del espacio separadas por ángulos de 105º. Esta disposición determina la forma de un tetraedro, tal es la estructura cristalina del hielo. El cambio al estado líquido implica la ruptura de muchos puentes, que se hacen más transitorios, es decir que se rompen y vuelven a formarse entre otras moléculas con mucha rapidez. Al estado gaseoso, la mayor parte de los puentes desaparece, pero aún se conservan algunos de ellos.
 |
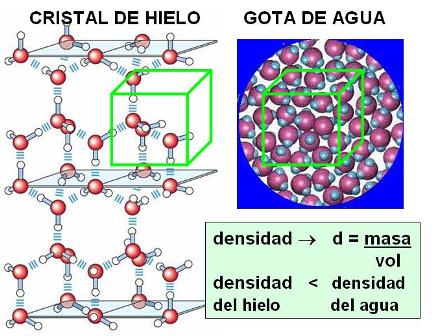
Por regla general, toda sustancia, sea en estado sólido, líquido o gaseoso, se contrae o disminuye su volumen al enfriarse. El agua también sigue esta regla dentro de un amplio intervalo de temperatura. Partiendo de 100º y hasta llegar a 4º C el volumen disminuye en forma continua. A partir de los 4º C y hasta el punto de congelación, el proceso se invierte: en lugar de seguir contrayéndose, el agua se dilata. Esto obedece a que, al disminuir los movimientos moleculares, los puentes de hidrógeno se fijan, congelando a las moléculas en una red en la que las distancias entre una y otra son mayores. En la red cristalina del hielo, las moléculas están más separadas unas de otras que al estado líquido. Caben más moléculas en 1 cm3 de agua líquida que en un 1 cm3 de hielo. Dicho en otros términos: la densidad o relación masa/volumen del agua líquida es mayor que la densidad del hielo.
 |
 |
La menor densidad del hielo con respecto al agua líquida hace que el hielo flote. ¿Qué pasaría si el agua se comportara como otras sustancias y el hielo fuera más denso que el agua líquida? Los mares, ríos y lagos se congelarían desde el fondo a la superficie y gran parte del agua dejaría de estar disponible para los seres vivos. En cambio, la flotabilidad del hielo permite la continuidad de la vida debajo de la capa superficial congelada de los cuerpos de agua.
Otra de las propiedades inusuales del agua es su alto calor específico. El calor específico se define como la cantidad de calor que hay que entregar a 1 gramo de una sustancia para elevar 1 grado su temperatura. Si las fuerzas de atracción entre las moléculas de una sustancia son débiles, al absorber calor, rápidamente entrarán en agitación, produciendo un aumento de la temperatura. Si por el contrario, las fuerzas de atracción son fuertes, deberá entregarse una cantidad mayor de energía calórica para que las moléculas se separen y aumenten sus movimientos, con el consiguiente aumento de temperatura. Este último es el caso del agua, cuyas moléculas se mantienen fuertemente cohesionadas por los puentes de hidrógeno. Por eso el agua puede absorber grandes cantidades de calor sin que su temperatura aumente en forma significativa, o entregar grandes cantidades de calor sin que su temperatura descienda abruptamente. Por ejemplo, si se coloca una olla vacía sobre el fuego, pronto se pondrá al rojo, pero si se la llena de agua, en el mismo lapso, la temperatura del agua solo aumentará unos pocos grados. O la misma radiación solar impactando sobre el suelo arenoso y el agua, producirá un aumento de temperatura mucho más marcado sobre el suelo que sobre el agua. Un gramo de agua necesita 10 veces más calor que un gramo de hierro o 5 veces más calor que un gramo de arena para incrementar en el mismo valor su temperatura. Es decir, el agua tiene un calor específico igual a 10 veces el del hierro o 5 veces el de la arena. Con su alto calor específico, el agua posee un importante efecto moderador de la temperatura. Este efecto moderador no solo se pone en juego en el ambiente, sino también en el organismo, cuya mayor parte está constituida por agua.
 |
A la capacidad termorreguladora del agua contribuyen también su alto calor de fusión y de vaporización. Siempre que la temperatura de un sólido aumenta hasta alcanzar su punto de fusión, o la de un líquido, hasta alcanzar su punto de ebullición, se produce un proceso de transición, durante el cual ambas fases (sólido y líquido o líquido y vapor) coexisten. En este lapso, hasta que la fusión o vaporización se completan, se absorbe calor sin que varíe la temperatura. El valor del calor absorbido, en el caso del agua, es muy alto. Cuando en los días de alta temperatura ambiente el cuerpo transpira, el agua eliminada vaporiza sobre la piel, tomando de ésta el calor necesario para el proceso. Como el calor de vaporización es alto, este fenómeno contribuye a retirar gran parte del calor corporal, colaborando en la regulación de la temperatura del cuerpo.
La marcada tendencia a la cohesión del agua hace que ésta tienda a “cerrarse” sobre sí misma. Por eso las gotas tienen forma esférica, ya que ésta es la forma que ofrece menor superficie para un volumen dado. La fuerte cohesión provoca que la superficie del agua se comporte como una película o membrana. Esa fuerza resultante de la cohesión recibe el nombre de tensión superficial. Con excepción del mercurio, el agua posee la tensión superficial más elevada de todos los líquidos comunes.
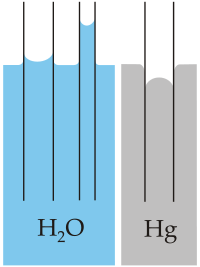 |
La cohesión sumada a la adhesión (unión de las moléculas de agua a otras superficies sólidas) da por resultado el fenómeno de capilaridad. La capilaridad es la capacidad del agua de elevarse en forma de columna por tubos capilares (de diámetro delgado como un cabello). Este fenómeno está relacionado con el movimiento del agua en los suelos, el transporte por los vasos de conducción de las plantas y la circulación de la sangre. |
Capacidad disolvente del agua: sustancias hidrofóbicas, hidrofílicas y anfipáticas Regresar
Dado que el agua es la sustancia más abundante en el organismo, es de suma importancia entender cómo interacciona con las otras sustancias, orgánicas o inorgánicas, que forman parte de un ser vivo. Según el comportamiento que las sustancias tengan frente al agua, aquéllas pueden ser clasificadas en tres categorías: hidrofóbicas, hidrofílicas y anfipáticas.
 |
El término hidrofóbica significa “que teme al agua”. Las sustancias hidrofóbicas son aquéllas que, debido a su estructura química, no tienen afinidad por el agua. Esto ocurre cuando la sustancia es apolar o no polar. Un ejemplo por todos conocido es el del aceite, que no forma mezclas con el agua. Cuando este tipo de sustancias se coloca en un medio acuoso, tienden a agruparse entre sí, “huyendo” del agua y ofreciendo a ésta la menor superficie de contacto posible. A ese comportamiento se lo denomina interacción hidrofóbica. |
Las sustancias hidrofílicas son las que tienen “amor por el agua”. Se trata de compuestos con algún tipo de polaridad, ya sean iónicos (con carga neta) o polares sin carga neta, pero con densidad de carga. Este tipo de sustancias son atraídas por las moléculas de agua, también polares, y se mezclan con ellas formando distintas clases de sistemas dispersos: soluciones, dispersiones coloidales y suspensiones.
Antes de profundizar en las interacciones que el agua establece con las sustancias polares, se hace necesario precisar algunos conceptos:
Sistema material : es una porción de materia que se aísla para su estudio. |
Sistema material disperso : es aquél en el cual hay al menos dos fases: la fase continua o dispersante y la fase dispersa, que está subdividida dentro de la fase dispersante. |
Sistema homogéneo : es el que presenta las mismas propiedades en todos sus puntos. |
Sistema heterogéneo : aquél cuyas propiedades no son constantes en todo el sistema. |
Solución : sistema disperso homogéneo formado por soluto (fase dispersa) y solvente (fase dispersante). Las partículas del soluto tienen un diámetro de hasta 1 nm (nm=nanómetro=10 - 7 m ). |
Dispersión coloidal : sistema disperso heterogéneo. Las partículas de la fase dispersa tienen un diámetro comprendido entre 1 y 100 nm. |
Suspensión : sistema disperso heterogéneo. Las partículas dispersas tienen un diámetro superior a los 100 nm. |
|
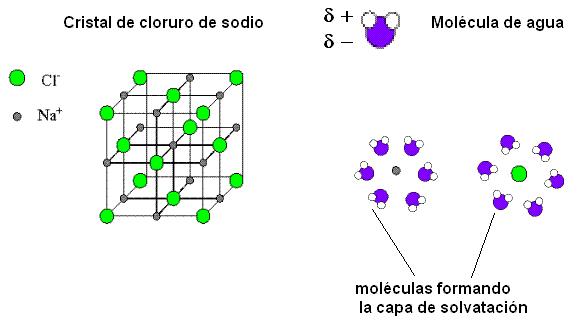
El agua interacciona con los compuestos iónicos, como el cloruro de sodio, formando soluciones iónicas. El cloruro de sodio es un compuesto cristalino en el cual los iones ocupan posiciones definidas, formando un retículo que se repite en las tres dimensiones del espacio. Los cationes Na+ y los aniones Cl- se alternan ocupando los vértices de cubos imaginarios, de manera que cada Na+ queda rodeado por 6 Cl- y cada Cl- queda rodeado por 6 Na+.
Cuando el agua se pone en contacto con los cristales de cloruro de sodio, los polos positivos de las moléculas de agua son atraídos por los iones Cl- mientras que sus polos negativos son atraídos por los iones Na+. Las moléculas de agua rodean a los iones formando a su alrededor una “capa de solvatación”. La mayor distancia entre catión y anión debilita la unión iónica, produciendo la disolución del cristal. Debido a este comportamiento del agua frente a las partículas con carga, la fuerza de atracción entre dos iones en el agua es sólo 1/80 de la fuerza que actuaría en el vacío. La capacidad del agua para separar iones es muy alta, y técnicamente esta propiedad se expresa como una “alta constante dieléctrica del agua”. El agua es, entonces, un excelente disolvente para los compuestos iónicos.
 |
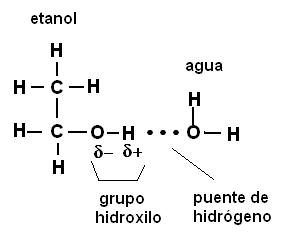
Los compuestos covalentes polares se mezclan con las moléculas de agua estableciendo con ellas uniones puente de hidrógeno. La afinidad de estos compuestos polares por el agua se hace evidente cuando el agua “moja” determinadas superficies, por ejemplo las fibras de algodón (formadas por celulosa) o los componentes del suelo (arcillas).
Cuando las sustancias polares tienen PM relativamente bajos (las moléculas son pequeñas) se disuelven en agua, formando soluciones moleculares, sistemas homogéneos en los cuales las moléculas del soluto quedan rodeadas por las del solvente (agua) y enlazadas a ellas por medio de los puentes de hidrógeno. Por ejemplo, el alcohol fino (etanol) y los azúcares en general, entre ellos la sacarosa o azúcar de caña, se disuelven en agua de esta forma. Los puentes de hidrógeno se forman entre los átomos de oxígeno del agua y los átomos de hidrógeno del grupo hidroxilo (-OH) presente en estos compuestos.
 |
Otras sustancias polares de mayor PM, como por ejemplo el almidón o ciertas proteínas, que son macromoléculas, se dispersan en agua formando sistemas heterogéneos, como las dispersiones coloidales o las suspensiones, ya que el tamaño de las partículas dispersas supera el límite de las soluciones. Los coloides o dispersiones coloidales pueden existir en dos estados, llamados estado de sol y estado de gel. En el estado de sol el agua actúa como fase dispersante. En el estado de gel, el sólido (macromolécula) forma redes en cuyos intersticios se ubican las moléculas de agua, es decir que éstas pasan a ser la fase dispersa.
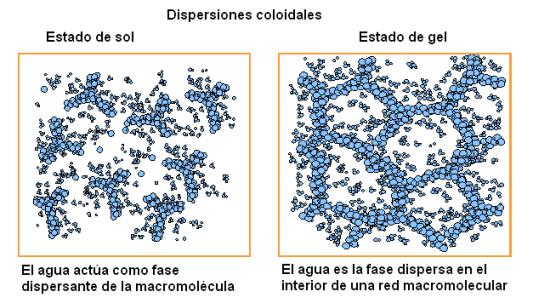 |
Existen compuestos en los cuales una parte de la molécula es polar (con densidad de carga o incluso con carga neta), pero otra parte de la misma molécula es no polar. Por consiguiente, una parte de la molécula es afín al agua o hidrofílica, mientras que la otra rechaza al agua, es hidrofóbica. Cuando zonas hidrofílicas e hidrofóbicas conviven en la misma molécula, se dice que ésta es una molécula anfipática (con ambos tipos de afinidad). Las moléculas anfipáticas tienen un comportamiento especial en medios acuosos, donde se disponen formando estructuras en forma de bicapas o micelas. Dichas estructuras son de gran importancia en la organización de las membranas y otros procesos biológicos y serán analizadas más adelante.
En el siguiente cuadro se resume la interacción del agua con distintos tipos de compuestos:
| Comportamiento de las sustancias frente al agua |
| Sustancias hidrofóbicas |
Compuestos covalentes apolares |
No se mezclan con agua |
| Sustancias hidrofílicas |
Compuestos con polaridad |
Compuestos iónicos |
Soluciones iónicas |
| Compuestos covalentes polares |
De bajo PM |
Soluciones moleculares |
| De alto PM |
Dispersiones coloidales |
| Suspensiones |
| Sustancias anfipáticas |
Sustancias con parte polar y parte no polar |
Bicapas |
| Micelas |
Es una expresión frecuente referirse al agua como “un solvente universal”. De lo recientemente expuesto se desprende que el agua no disuelve a todas las sustancias, pero sí que forma soluciones o dispersiones con una gran cantidad de ellas. Esta fuerte capacidad disolvente o al menos dispersante del agua es la que la convierte en el medio ideal para muchas funciones orgánicas:
- es el medio en el que otras sustancias se encuentran y reaccionan, es decir el medio en el que transcurre el metabolismo,
- es el vehículo de los nutrientes y otras sustancias en la sangre,
- es el disolvente de los productos de desecho que excretamos en la orina o el sudor.
Incluso lo que a primera vista pareciera un desventaja, como la incapacidad del agua de mezclarse con las sustancias hidrofóbicas, tiene útiles consecuencias, como veremos al tratar el tema de los depósitos grasos.
Concentración Regresar
Los líquidos corporales son soluciones en las cuales es necesario mantener la concentración de determinados solutos dentro de ciertos valores, para que las funciones orgánicas se lleven a cabo adecuadamente.
Se entiende por concentración (c) de una solución a la relación existente entre la cantidad del soluto (st) y la cantidad del solvente (sv) o de la solución (sn).
Esta relación puede expresarse de distintas formas, por ejemplo:
masa de soluto/volumen de solvente |
c = 10g de sacarosa / 1l de agua |
masa del soluto/volumen de la solución |
c = 10 g de sacarosa / 1l de sn (el volumen total que ocupan el soluto y el solvente) |
porcentaje masa / volumen = %m/v |
c = g de st / 100 cm3 de sn |
Molaridad = M |
M = Nº de moles de st / l de sn |
Molalidad = m |
m = Nº de moles de st / kg de sv |
Osmolaridad |
c = Nº de osmoles de st / l de sn |
Osmolalidad |
c = Nº de osmoles de st / kg de sv |
La molaridad, molalidad, osmolaridad y osmolalidad son formas de expresar la concentración en número de partículas disueltas y no en masa de partículas disueltas. Puesto que algunas propiedades de las soluciones dependen del número de partículas de soluto, estas formas de expresar la concentración son útiles en determinados contextos.
Ya hemos visto que un mol de partículas equivale 6,02 x 1023 partículas. También sabemos que se puede realizar la conversión de moles a masa, pues un mol de una sustancia tiene una masa en gramos igual a su peso molecular.
Ahora bien, cuando el soluto es un compuesto iónico y el solvente es el agua, los iones se separan. Esto significa que si se coloca un mol de cloruro de sodio en agua, no habrá 6,02 x 1023 partículas disueltas, sino el doble, es decir, 6,02 x1023 cationes sodio y 6,02 x1023 aniones cloruro.
Para contemplar situaciones como la anterior se utiliza el osmol.
Un osmol (osm) de un compuesto es igual a la masa del mol dividida por el número de iones en que se separa cuando está en solución.
| 1 osm = masa del mol / Nº de iones en que se disocia |
Para los compuestos que no se ionizan, el número de moles equivale al número de osmoles. Para los compuestos que se ionizan, en cambio, el número de osmoles será igual al número de moles multiplicado por el número de partículas liberadas en la ionización. Por ejemplo:
| |
Glucosa |
NaCl |
PM |
180 |
58 |
Masa de 1 mol |
180g |
58g |
Molaridad ->Solución 1 molar |
180g / l de sn |
58g / l de sn |
Molalidad ->Solución 1 molal |
180g / Kg de sv |
58g / Kg de sv |
1 osmol |
180g |
58g% 2 = 29g |
Osmolaridad ->Solución 1 osmolar |
180g / l de sn |
29g / l de sn |
Osmolalidad ->Solución 1 osmolal |
180g / Kg de sv |
29g / kg de sv |
Disociación del agua y Potencial de Hidrógeno (pH) Regresar
La disociación o ionización del agua es una reacción reversible en la cual una molécula de agua se separa en dos iones: un grupo hidroxilo y un protón. En la disociación del agua, la unión covalente polar entre el átomo de oxígeno y uno de los hidrógenos se rompe. Los dos electrones antes compartidos son retenidos por el oxígeno. Así, el grupo atómico formado por el oxígeno y el otro hidrógeno (que permanecen unidos covalentemente), adquiere un electrón extra, convirtiéndose en un anión con una carga negativa; ese anión es el grupo hidroxilo.
Por otro lado, queda un átomo de hidrógeno desprovisto de su electrón, lo que equivale a decir un núcleo de hidrógeno, o simplemente, un protón.
El agua tiene una baja tendencia a ionizarse. Como al ionizarse una molécula de agua se obtienen un OH- y un H+, la concentración de ambos iones en el agua pura es la misma y es igual a 10-7 moles / l.
[ ] = concentración
En el agua pura: [OH-] = [H+] = 10-7 mol/l
En química se utiliza la magnitud Potencial de hidrógeno o pH para indicar la concentración de protones [H+] o grado de acidez de un medio. El pH se define como el logaritmo negativo de la concentración de protones.
Potencial de hidrógeno = pH = - log [H + ]
Para el agua pura -> pH = 7
La escala de pH va de 1 a 14. El valor 7 corresponde a un medio neutro; un valor inferior a 7, a un medio ácido y un valor por encima de 7, a un medio básico o alcalino.
Al elegir el pH como expresión de la concentración de protones o acidez de un medio, cuanto mayores son éstas, menor resulta el valor de pH. Por ejemplo, comparemos los medios A y B.
Para A -> [H+] = 0,001 mol/l = 10-3 mol/l -> pH = 3
Para B -> [H+] = 0,0001 mol/l = 10-4 mol/l -> pH = 4
El medio A es más ácido y tiene una concentración de protones 10 veces mayor que la del medio B.
Ácidos y Bases Regresar
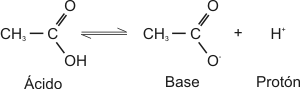
Un ácido es una sustancia que, en solución acuosa, tiende a disociarse liberando un protón.
Una base o álcali es una sustancia que, en solución acuosa, capta protones del medio.
Los ácidos y las bases se catalogan como fuertes o débiles según su mayor o menor tendencia a ceder o captar protones, respectivamente.
 |
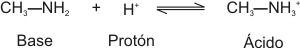 |
Lo que resta de la molécula de ácido, después de la cesión del protón, es su base conjugada. Si el ácido es fuerte, su base conjugada es débil y viceversa.
De la misma manera, el catión que se forma cuando una base ha captado un protón del medio, es el ácido conjugado de aquélla. Si la base es fuerte, su ácido conjugado es débil, y viceversa.
Hemos mencionado que, en el agua pura, la concentración de protones es igual a la de hidroxilos. Cuando al agua se le agrega un ácido, la concentración de protones supera a la de hidroxilos, porque a los liberados por el agua disociada se les suman los protones liberados por el ácido.
De modo inverso, cuando al agua se le agrega una base, ésta capta protones libres. Por lo tanto, la concentración de hidroxilos va a superar a la de protones. Entonces:
| Medio neutro |
[H+] = [OH-] |
| Medio ácido |
[H+] > [OH-] |
| Medio básico |
[H+] < [OH-] |
Buffers o amortiguadores del pH Regresar
Los valores de pH en diferentes compartimentos del organismo deben ser mantenidos dentro de rangos muy estrechos, para que el metabolismo se lleve a cabo adecuadamente. Pequeñas desviaciones en el pH sanguíneo causan la muerte. Para compensar esas desviaciones del pH, tanto en la sangre como en la célula existen los buffers o amortiguadores. Un buffer es un moderador del pH que está compuesto por un par conjugado ácido/base. Al contener el ácido y la base, el buffer puede ceder o captar protones según las circunstancias, retornando el pH a sus valores normales.
Compuestos orgánicos: generalidades Regresar
Los compuestos orgánicos son derivados del elemento carbono. Con número atómico 6, el átomo de carbono presenta 2 electrones en el nivel 1 y 4 electrones en el nivel 2, que es su nivel más externo. Por lo tanto, el carbono se estabiliza estableciendo 4 uniones covalentes. Las 4 valencias o posibilidades de unión del carbono se orientan en el espacio hacia los vértices de un imaginario tetraedro regular, cuyo centro está ocupado por el núcleo del átomo. No obstante esta orientación en el espacio, las uniones del carbono se representan gráficamente como si se hallaran sobre un mismo plano.
Los átomos de carbono tienen la particularidad de unirse entre sí, mediante uniones covalentes, que pueden ser ligaduras simples, dobles o triples, según los pares de electrones que comparten.
Al unirse entre ellos, los átomos de carbono forman cadenas lineales, cadenas ramificadas y ciclos.
Según su posición en una cadena, un átomo de carbono puede estar unido a un solo átomo de carbono, a otros dos, a tres, o a cuatro átomos de carbono. Estas diferencias permiten clasificarlos en carbonos primarios, secundarios, terciarios y cuaternarios.
Los compuestos orgánicos más simples son los hidrocarburos, en los cuales las valencias del carbono se completan con átomos de hidrógeno. Por ejemplo:
Cuando todos los enlaces entre carbonos son simples, el compuesto está saturado de hidrógeno. Si existen dobles o triples enlaces entre carbonos, la cantidad de hidrógeno es menor y el compuesto es insaturado.
La enorme variedad de compuestos orgánicos deriva de los hidrocarburos, mediante sustitución de uno o más hidrógenos por otros átomos o grupos atómicos (por eso a los átomos o grupos atómicos distintos del hidrógeno que están unidos a un carbono se los suele llamar “sustituyentes”).
Se denomina grupo funcional a los átomos o grupos atómicos que, unidos a los carbonos de los compuestos orgánicos, son determinantes de las propiedades físico-químicas de los compuestos que los portan.
Una familia de compuestos con el mismo grupo funcional y, por lo tanto, con similares propiedades, recibe el nombre de función química. A los compuestos que pertenecen a la misma función química, en muchos casos, se los nombra agregando a la raíz de su nombre un sufijo que los identifica como tales.
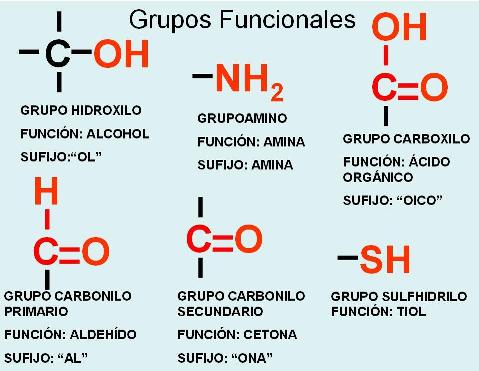 |
Muchas veces en química orgánica se hace referencia a los radicales (R). Se entiende por radical a un grupo atómico que tiene un electrón sin compartir (una valencia libre). Los radicales llevan el nombre del compuesto o la función de la cual derivan, cambiando la terminación por el sufijo “ilo”. Por ejemplo, el radical derivado del metano es el “metilo” o el derivado de un ácido orgánico, un “acilo”.
En química orgánica es muy común el fenómeno de isomería: la existencia de dos o más sustancias con la misma fórmula molecular, pero con diferentes propiedades. Estas sustancias son isómeros (iso: igual, mero: parte). Las moléculas de los isómeros están formadas por los mismos átomos, aunque distribuidos de distinta forma en el espacio.
Muchas de las moléculas orgánicas de importancia biológica tienen estructura de polímero. Un polímero (poli: mucho, mero: parte) es una molécula formada por un número grande de una o más moléculas “unidad”, a las que se llama monómeros (mono: uno). Existen homopolímeros (homo: igual) formados por la unión química de monómeros idénticos y heteropolímeros (hetero: distinto) que se obtienen por la unión de monómeros diferentes.
Glúcidos o hidratos de carbono Regresar
Definición y origen
 |
Los glúcidos, también llamados carbohidratos o hidratos de carbono, son compuestos orgánicos constituidos por carbono (C), hidrógeno (H) y oxígeno (O). Pueden definirse como polihidroxialdehídos o polihidroxicetonas y sus derivados. Los más simples son dulces y solubles en agua. Los de alto PM forman dispersiones coloidales o bien no se dispersan, aunque todos ellos son muy hidrofílicos.
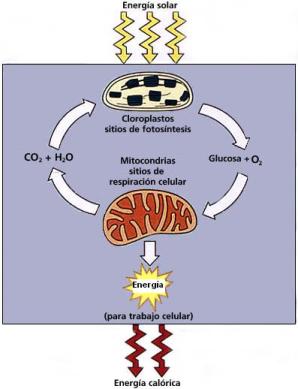
Las plantas elaboran y almacenan glúcidos como su principal fuente de energía. En los cloroplastos de las hojas, en presencia de clorofila, absorben luz solar y unen el dióxido de carbono del aire y el agua del suelo para formar glucosa, un glúcido esencial. De este proceso, la fotosíntesis, se libera oxígeno (O2) a la atmósfera, como producto secundario.
El carbohidrato sintetizado en la fotosíntesis se utiliza para formar glúcidos más complejos y otros compuestos orgánicos. Cuando los animales los consumen, estos compuestos son la base de la vida animal. En consecuencia, se podría decir que el sol proporciona la energía para toda la materia viviente.
En las mitocondrias, los vegetales y los animales recuperan la energía encerrada en dichos compuestos, metabolizándolos con la adición de oxígeno, durante la respiración celular. Así forman los subproductos agua y dióxido de carbono, necesarios para que las plantas inicien nuevamente el ciclo.
Clasificación Regresar
GLÚCIDOS |
Monosacáridos |
Oligosacáridos |
Polisacáridos |
Los glúcidos se clasifican en monosacáridos, oligosacáridos y polisacáridos. Los primeros son los más simples. Los oligosacáridos y los polisacáridos derivan de los glúcidos simples.
Monosacáridos Regresar
Los monosacáridos (mono: uno, unidad; sacárido: azúcar) son sustancias de sabor dulce, solubles en agua, formadas por cadenas de 3 a 7 átomos de carbono. Responden a la fórmula general
Cn (H2O)n, es decir que por cada átomo de carbono tienen dos de hidrógeno y uno de oxígeno, lo que les valió el nombre de “hidratos de carbono”.
El grupo funcional principal es el carbonilo, ya sea aldehído o cetona, en los carbonos 1 ó 2, respectivamente. A cada uno de los carbonos que forman el resto de la cadena se une un grupo hidroxilo.
Los monosacáridos, entonces, se clasifican del siguiente modo:
| Clasificación de los monosacáridos |
| Según el N° de C en la cadena |
3 |
Triosas |
| 4 |
Tetrosas |
| 5 |
Pentosas |
| 6 |
Hexosas |
| 7 |
Heptosas |
| Según el grupo carbonilo |
Aldehído |
Aldosas |
| Cetona |
Cetosas |
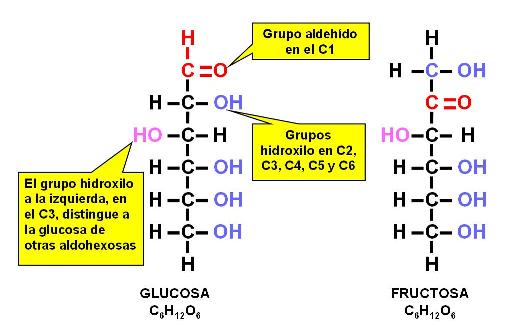
Las hexosas son los monosacáridos más abundantes en la naturaleza, entre ellos la glucosa (una aldohexosa), el azúcar que circula en sangre y combustible celular por excelencia y la fructosa (una cetohexosa), azúcar presente en los frutos y la miel.
 |
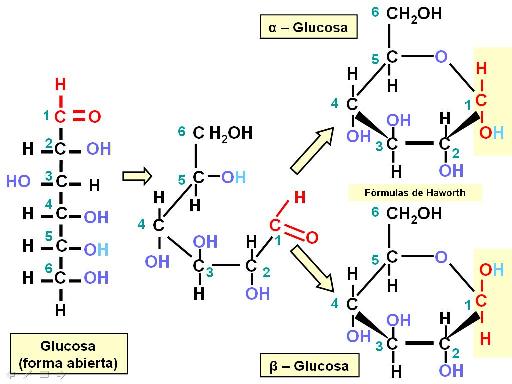
Las pentosas y las hexosas pueden existir en dos formas estructurales: como cadenas lineales o como ciclos. Las formas cíclicas son las más frecuentes en solución acuosa. Además, cada forma cíclica tiene dos isómeros: alfa y beta.
En el siguiente esquema se representa el proceso de ciclización de la glucosa. Los ángulos de unión entre los carbonos hacen que los extremos de la cadena se acerquen (se debe recordar que el átomo de C tiene estructura tetraédrica y sus uniones no se establecen en un solo plano, como se representa en el papel). El grupo aldehído del primer carbono reacciona con el grupo hidroxilo del quinto carbono. Así se forma un anillo hexagonal, uno de cuyos vértices es un átomo de oxígeno. Al formarse el ciclo, el grupo aldehído del primer carbono desaparece y su lugar lo ocupa un hidroxilo. Este nuevo hidroxilo en el primer carbono puede adoptar dos posiciones: por encima o por debajo del plano del anillo. Dichas alternativas son las que dan lugar a la formación de los dos isómeros cíclicos: alfa y beta.
La representación de las estructuras cíclicas se realiza mediante las fórmulas de Haworth. Al pasar de la fórmula de estructura abierta a la de Haworth, los sustituyentes que estaban hacia la izquierda en la fórmula lineal quedan por encima del anillo y los que estaban a la derecha, por debajo de aquél.
 |
Unión glicosídica Regresar
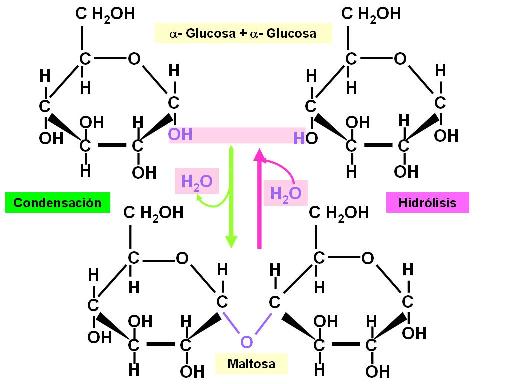
Los monosacáridos cíclicos, en particular las hexosas, se unen entre sí dando lugar a la formación de glúcidos más complejos. Genéricamente, esta unión recibe el nombre de unión glicosídica. Al formarse la unión, las hexosas quedan ligadas a través de un átomo de oxígeno, mientras que un protón y un hidroxilo se desprenden, formando una molécula de agua.
Toda unión química que se forma con desprendimiento de una molécula de agua es una condensación. La reacción inversa de la condensación es una hidrólisis (hidro: agua, lisis: ruptura). Significa que, adicionando agua, que aporta un protón y un hidroxilo, se rompe la unión, volviendo a obtenerse las moléculas originales.
En la figura se ilustra la formación de una unión glicosídica entre dos moléculas de alfa glucosa, en la cual intervienen el hidroxilo en posición 1 y el hidroxilo en posición 4 de las moléculas de glucosa reactivas. Por esto la unión se simboliza como alfa (1->4). El producto obtenido es el azúcar maltosa.
 |
Las uniones glicosídicas dan origen a una gran variedad de compuestos, en función de distintos factores: cuáles son los monosacáridos que reaccionan, si participan con sus formas alfa o beta, en qué posición se ubican los hidroxilos que reaccionan y finalmente, cuántas unidades de monosacáridos se integran a la cadena mediante estas uniones.
Oligosacáridos Regresar
Los oligosacáridos (oligo: poco; sacárido: azúcar) se obtienen de la unión glicosídica de entre 2 y 10 monosacáridos. Los disacáridos y los trisacáridos son azúcares, pues conservan el sabor dulce.
Los oligosacáridos más representados en la naturaleza son los disacáridos. Entre ellos, la maltosa o azúcar de malta, ya mencionada; la sacarosa o azúcar de caña, transportada por las plantas a través de sus tallos y utilizada en la alimentación humana; y la lactosa o azúcar de leche. En los tres la glucosa es, cuando menos, uno de sus componentes:
| Disacárido |
Unidades |
Ubicación |
| Maltosa |
alfa-glucosa + alfa-glucosa |
Producto de la hidrólisis del almidón |
| Sacarosa |
alfa-glucosa + beta-fructosa |
Azúcar de caña |
| Lactosa |
alfa-glucosa + beta-galactosa (otra aldohexosa) |
Azúcar de leche |
Otros oligosacáridos de mucha significación para los seres vivos son los oligosacáridos de membrana, compuestos ramificados, presentes en las membranas celulares, donde forman parte de estructuras receptoras.
Polisacáridos Regresar
Los polisacáridos son polímeros, pues constan de numerosas unidades de monosacáridos unidas por enlaces glicosídicos.
Los polisacáridos pueden ser homopolisacáridos, cuando están formados por una sola clase de monómero, o heteropolisacáridos, originados por la repetición de dos monómeros distintos, que se alternan en la cadena del polímero.
Los heteropolisacáridos son muy importantes por su papel estructural en la matriz extracelular de los tejidos conectivos. Se caracterizan porque uno de los monómeros suele ser un derivado de monosacáridos, por ejemplo azúcares con grupo amino, sulfato o ácido.
En cuanto a los homopolisacáridos, los más abundantes son polímeros de glucosa (glucanos o glucosanos); también hay polímeros de fructosa (fructosanos) o de manosa, otra aldohexosa (mananos).
El almidón, el glucógeno y la celulosa son glucanos de gran importancia biológica. Los dos primeros están constituidos por alfa glucosa y el tercero, por beta glucosa.
El almidón es en realidad una mezcla de dos polímeros en proporciones variables, la amilosa y la amilopectina. La amilosa es una cadena lineal que adopta una disposición helicoidal, pero la amilopectina es ramificada, ya que presenta cadenas secundarias unidas a la cadena principal.
Si bien es prácticamente insoluble en agua fría, el almidón se dispersa cuando se lo calienta; entonces atrae gran cantidad de agua y forma un gel estable.
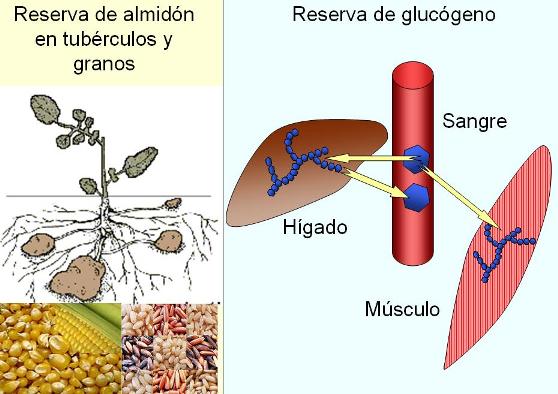
El almidón es sintetizado por las plantas como su principal reserva energética y se deposita en forma de gránulos, en tubérculos, raíces reservantes, granos de cereal y semillas, como las leguminosas. El tamaño de los gránulos y el peso molecular del almidón son muy variables, pues dependen de la actividad metabólica y las necesidades de la planta. Cuando la actividad fotosintética es intensa, se añaden unidades de glucosa, mientras que, por el contrario, el almidón se hidroliza si la planta requiere sus reservas para la obtención de energía.
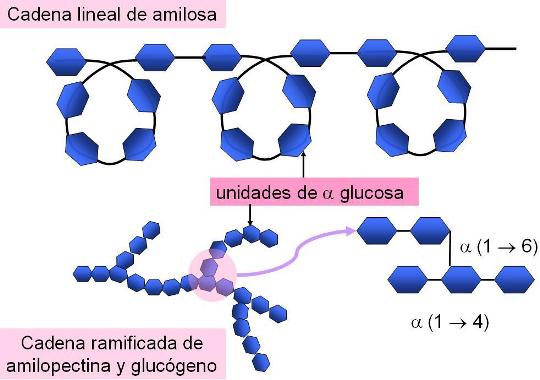 |
El glucógeno, llamado almidón animal, posee una estructura similar a la de la amilopectina, aunque sus cadenas son más cortas y ramificadas. Es un polisacárido de reserva y se encuentra principalmente en el hígado y el músculo, a concentraciones del 10 y 2%, respectivamente. Si la concentración de glucosa en sangre disminuye, el glucógeno hepático es hidrolizado para aportar glucosa a la sangre y así suministrar este combustible a las células. La reserva de glucógeno muscular, en cambio, es consumida por este tejido durante la actividad física.
 |
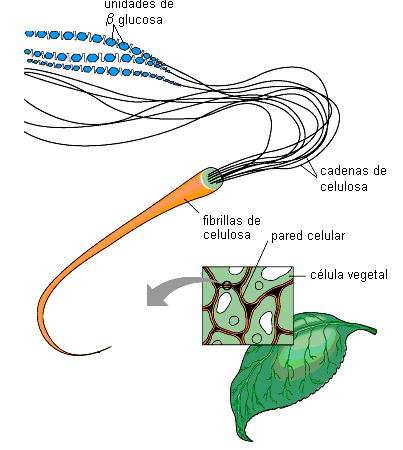 |
La celulosa es un polisacárido estructural. Es un material fibroso insoluble, cuyas cadenas muy largas y lineales, se unen entre sí mediante puentes de hidrógeno, constituyendo fibrillas. Dichas fibrillas son el material de sostén en las paredes celulares que rodean a las células vegetales.
Para el hombre, además de los azúcares, el almidón y la celulosa son los hidratos de carbono de mayor presencia en la alimentación. El almidón se digiere en el tubo digestivo, hidrolizándose por completo a glucosa, la cual se incorpora al torrente sanguíneo. Aunque la celulosa consiste también en unidades de glucosa, no puede ser hidrolizada a su monómero absorbible en el intestino del hombre. Existen enzimas digestivas que hidrolizan las uniones entre moléculas de glucosa en el almidón, pero las uniones entre moléculas de glucosa de la celulosa no se ven afectadas por ninguna de las enzimas digestivas del hombre. A medida que las moléculas de celulosa avanzan por el tubo digestivo para ser eliminadas, cumplen una función útil: forman volumen, lo que favorece la evacuación intestinal. Sin embargo, todas las moléculas de glucosa que contiene no están disponibles para la producción de energía. Los animales herbívoros, en cambio, pueden aprovechar la energía que encierra la celulosa, gracias a que poseen en su tubo digestivo una flora microbiana con las enzimas necesarias para hidrolizarla.
Lípidos Regresar
Definición
Los lípidos son un grupo heterogéneo de sustancias, cuyo carácter común es su insolubilidad en agua y su solubilidad en compuestos orgánicos como éter, benceno y cloroformo.
Ácidos grasos Regresar
Son los lípidos más simples. Aunque se los halla en pequeña cantidad en estado libre en los organismos, su importancia radica en que forman parte de las moléculas de la mayoría de los lípidos.
Los ácidos grasos (AG) son ácidos orgánicos, monocarboxílicos, que, salvo contadas excepciones, presentan una cadena hidrocarbonada lineal y número par de átomos de carbono.
La cadena de los ácidos grasos puede ser saturada (sin dobles ligaduras) o insaturada (con una o más dobles ligaduras).
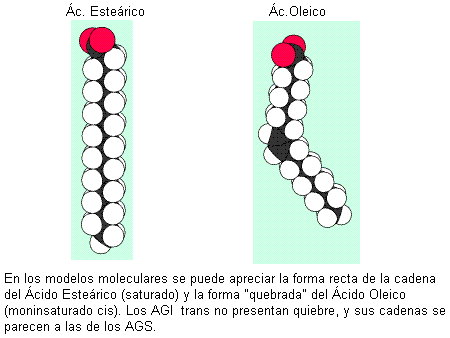
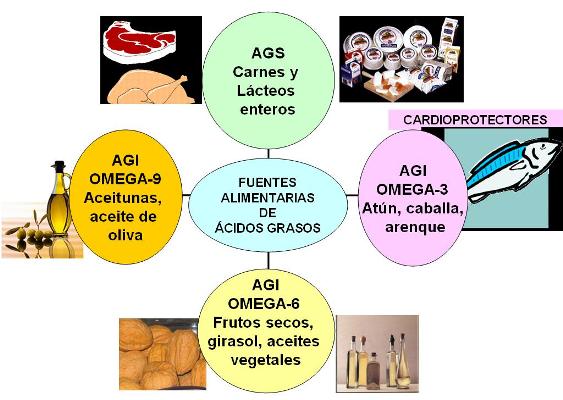
Los ácidos grasos más abundantes en los animales son los de 16 y 18 átomos de carbono, considerados de cadena larga. Por ejemplo: el ácido esteárico, un ácido graso saturado (AGS) de 18 C y el oleico, un ácido graso también de 18 C, monoinsaturado (AGM).
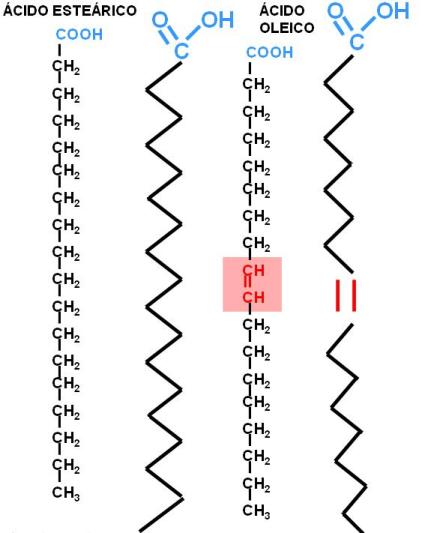 |
Los átomos de C de un AG se enumeran a partir del grupo carboxilo, que es el grupo funcional principal. Los C adyacentes al carboxilo se denominan alfa y beta y el grupo metilo terminal corresponde al C omega o n.
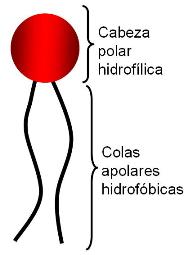
Los AG son moléculas anfipáticas, pues poseen un grupo polar, el carboxilo, la “cabeza” de la molécula, y una larga “cola” apolar, la cadena hidrocarbonada.
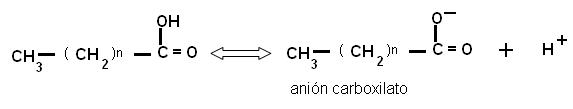
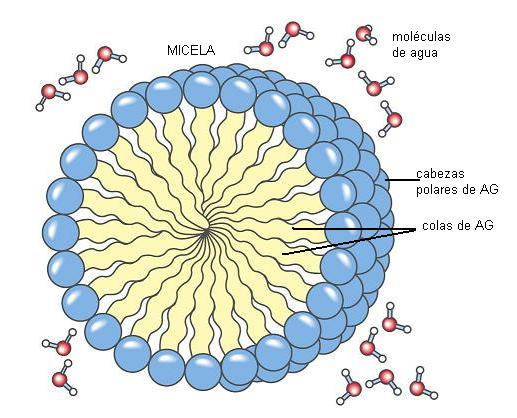
El grupo carboxilo es un ácido débil, con baja tendencia a la disociación. En medio acuoso, los aniones carboxilato pueden formar emulsiones (dispersiones de líquido en líquido), agrupándose en pequeñas gotas llamadas micelas. Por su carácter anfipático, en cada micela los aniones de AG se ubican orientando sus colas hidrofóbicas hacia el interior de la micela, mientras que las cabezas polares se ponen en contacto con el agua circundante. Estas emulsiones son más estables si el AG forma un compuesto iónico o una sal con un metal, por ejemplo el Na+. Las sales de AG se denominan jabones.
 |
 |
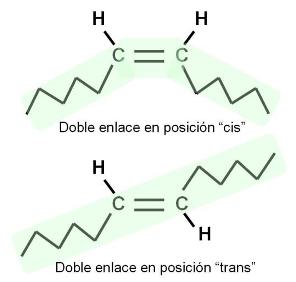
Los AG insaturados presentan isómeros geométricos, llamados cis y trans. Éstos se diferencian en la posición de los restos de cadena a ambos lados de la doble ligadura, según se aprecia en el esquema. En los isómeros cis, ambas cadenas se ubican hacia el mismo lado, mientras que en los trans, las cadenas se orientan hacia lados opuestos. La mayoría de los AG naturales adopta la posición cis. Esto se traduce en un ángulo en la cadena del AG a la altura de cada doble enlace. Los AG saturados y los trans, en cambio, tienen cadenas rectas.
La geometría de la molécula influye en el punto de fusión del AG. Los saturados y los trans, con sus formas rectilíneas, pueden acercarse más entre sí, lo que aumenta las fuerzas de atracción entre ellos. Esto determina que tengan puntos de fusión elevados: son menos fluidos a temperatura ambiente. Los AG cis, en cambio, no pueden acercarse tanto unos a otros, pues los limita el ángulo de sus cadenas. Entonces las fuerzas de atracción son más débiles y sus puntos de fusión, menores. A temperatura ambiente son más fluidos.
Desde el punto de vista de la salud, los ácidos grasos saturados y los ácidos grasos trans (obtenidos industrialmente y utilizados en la industria alimentaria) predisponen a la aterosclerosis, enfermedad caracterizada por la presencia de ateromas, placas que obstruyen los vasos sanguíneos.
 |
 |
 |
Triacilgliceroles (triglicéridos o grasas neutras) Regresar
Los ácidos grasos reaccionan con el glicerol, un triple alcohol, formando ésteres de glicerol o acilgliceroles. Cada molécula de glicerol puede reaccionar con una, dos, o tres moléculas de ácido graso, dando origen a un monoacilglicerol, un diacilglicerol o un triacilglicerol, respectivamente. La unión entre glicerol y ácido graso es una unión éster (nombre genérico de la unión entre alcohol y ácido) y se forma por condensación, es decir con liberación de una molécula de agua.
Entonces:
Los triacilgliceroles son los más abundantes, y se los conoce como triglicéridos o grasas neutras.
A continuación se esquematiza la formación de un triglicérido.
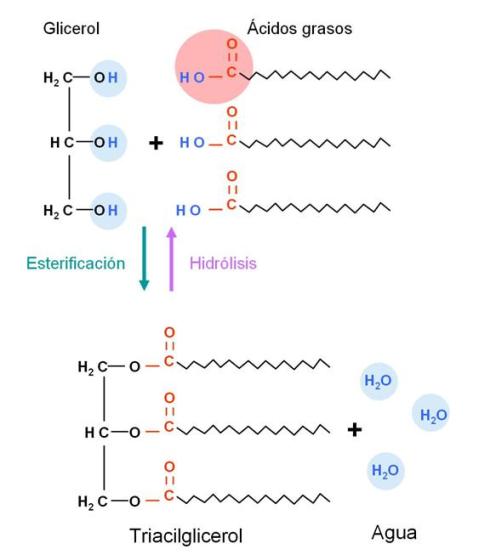 |
Los triglicéridos reciben el nombre de grasas neutras, pues son compuestos completamente no polares, lo que les impide mezclarse con el agua, es decir, son hidrofóbicos. Debe tenerse en cuenta que si bien, por separado, el glicerol es polar (debido a sus grupos hidroxilo) y los ácidos grasos son anfipáticos, las partes polares de estas moléculas participan del enlace éster y quedan completamente enmascaradas en el interior del triglicérido cuando están unidas.
Los triglicéridos generalmente son mixtos, esto es: están formados por mezclas de ácidos grasos distintos. Los triglicéridos en los que predominan los ácidos grasos saturados son sólidos o pastosos a temperatura ambiente y se denominan grasas. Cuando predominan los ácidos grasos insaturados, los triglicéridos son líquidos a temperatura ambiente y reciben el nombre de aceites.
Algunas plantas reservan aceites en sus frutos o semillas. Las grasas, en cambio, son productos típicamente animales. Los animales utilizan las grasas como su principal depósito de energía a largo plazo. Depósito que, por otra parte, es ilimitado.
¿Por qué el principal depósito de energía en los animales es la grasa y no el glucógeno (almidón animal)? En primer lugar, cuando se oxidan, las grasas proporcionan 9 Kcal/g, frente a las 4 Kcal/g que rinden los glúcidos. La densidad energética de las grasas es mucho mayor que la de los glúcidos.
En segundo lugar, los glúcidos son muy hidrofílicos. Esto significa que en un depósito de almidón o glucógeno hay un peso extra debido al agua que acumulan, el cual no rinde energía. Para las plantas, un depósito pesado no es problema porque no se trasladan. Pero para un animal que se desplaza, un depósito muy grande de glúcidos sería un lastre imposible de acarrear.
 |
Fosfolípidos y Glucolípidos Regresar
Los fosfolípidos pueden derivar del glicerol o de otro alcohol llamado esfingol. Los glicerofosfolípidos son ésteres de glicerol con dos ácidos grasos y un ácido fosfórico. Contienen además una base nitrogenada.
Los esfingofosfolípidos están compuestos por esfingol unido a un ácido graso (formando ceramida), ácido fosfórico y una base nitrogenada.
Los glucolípidos se forman a partir de la ceramida, que se une a un glúcido, el cual puede ser glucosa, galactosa o bien un oligosacárido.
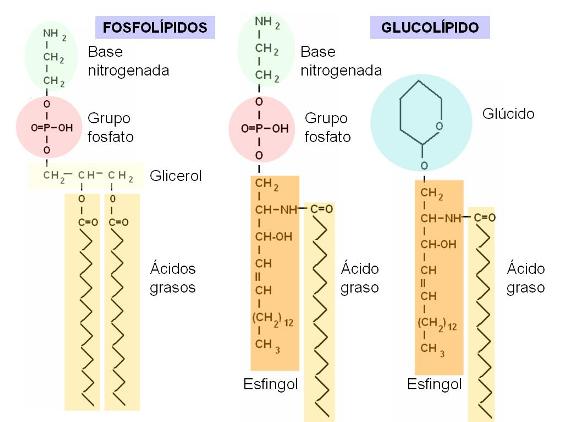 |
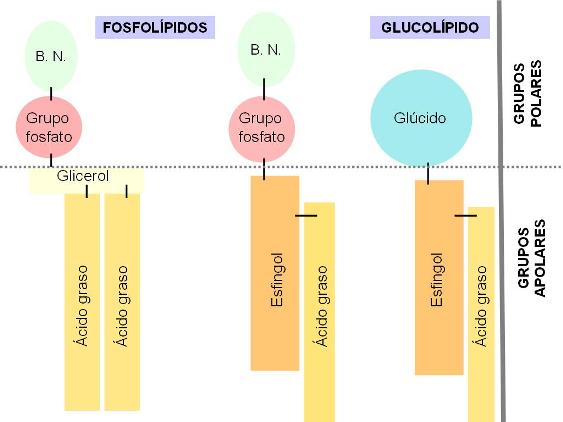
En los fosfolípidos, el grupo fosfato (derivado del ácido fosfórico) está unido a la base nitrogenada (en este caso: etanolamina). Los fosfoesfingolípidos y los glucolípidos tienen una parte común, la ceramida (esfingol + ácido graso). El grupo fosfato, las bases nitrogenadas y los glúcidos corresponden a las zonas polares de estas moléculas. Las colas de ácidos grasos y la larga cadena hidrocarbonada del esfingol son las zonas apolares. |
 |
 |
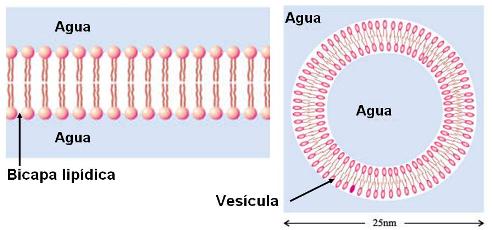
Tanto los fosfolípidos como los glucolípidos son moléculas anfipáticas. Llevan una “cabeza” que corresponde a sus grupos polares y es hidrofílica, y dos “colas” hidrofóbicas, correspondientes a sus partes no polares. Al igual que los ácidos grasos, pueden formar micelas. Sin embargo, su propiedad más importante es la posibilidad de formar bicapas, que se cierran sobre sí mismas, cuando se encuentran en un medio acuoso.
En una bicapa, estos lípidos se ubican con sus cabezas orientadas hacia el agua y sus colas enfrentadas, de modo que escapan del agua. Además, las bicapas se cierran, para no exponer al agua sus superficies laterales hidrofóbicas. Así forman pequeños sacos o vesículas.
Debido a su comportamiento frente al agua, los fosfolípidos y los glucolípidos son los compuestos ideales para formar el límite de la célula, una estructura rodeada de agua y con un contenido acuoso. En efecto, las membranas celulares son, básicamente, bicapas lipídicas.
A pesar de su contenido en ácidos grasos, los fosfolípidos y glucolípidos no cumplen una función energética, sino estructural.
 |
Colesterol Regresar
El colesterol es una sustancia relacionada con los lípidos (un lípido asociado) que pertenece al grupo de los esteroides. Tiene una estructura cíclica y un grupo hidroxilo. Aunque predomina su parte apolar, puede considerárselo anfipático. Como tal, es un componente importante de las membranas celulares animales (no de las vegetales), especialmente en determinados órganos, como cerebro, hígado y riñón.
Además, el colesterol es precursor o materia prima de muchas otras sustancias de importancia fisiológica: las hormonas esteroides, la vitamina D y las sales biliares.
Proteínas Regresar
Definición
Son polímeros lineales de L-aminoácidos unidos mediante enlace peptídico. Las proteínas son macromoléculas muy versátiles, que desempeñan tanto funciones estructurales como dinámicas.
Aminoácidos Regresar
Los aminoácidos son las moléculas unitarias, los monómeros de las proteínas. Todos los aminoácidos tienen una estructura común, que consiste en un átomo de carbono, el carbono alfa unido a un grupo carboxilo, un grupo amino y un átomo de Hidrógeno. La cuarta valencia del carbono alfa se completa con un grupo atómico de estructura variable, al que identificaremos como R (por Radical).
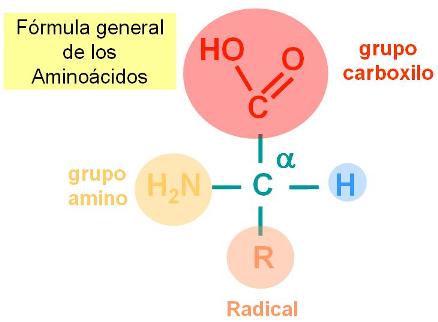 |
En el aminoácido de estructura más sencilla, la glicina, el R es un átomo de Hidrógeno.
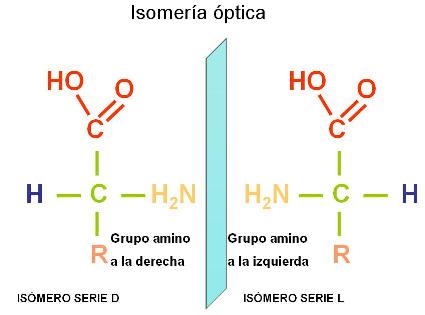
Exceptuando la glicina, en todos los demás aminoácidos el carbono alfa es un carbono asimétrico o quiral. Así se denomina a los átomos de carbono unidos a cuatro grupos atómicos diferentes.
Las moléculas que, como los aminoácidos, tienen carbonos asimétricos, presentan isomería óptica. Es decir, por cada carbono asimétrico existen dos formas isoméricas, llamadas isómeros ópticos, que son imágenes especulares una de la otra. Los isómeros ópticos pertenecen a las series D o L. Los aminoácidos utilizados por los seres vivos son siempre de la serie L. Éstos se representan con el grupo amino ubicado a la izquierda.
 |
En solución acuosa, los aminoácidos por lo general tienen carga eléctrica, ya que tanto el grupo amino como el carboxilo son ionizables.El grupo amino es básico y adquiere carga positiva cuando capta un protón. El grupo carboxilo, en tanto ácido, puede ceder un protón y adquirir carga negativa. Según la concentración de protones libres disponibles en el medio donde se encuentre (según el pH), el aminoácido será un catión, un anión, o un ión dipolar, si ambos grupos se ionizan simultáneamente.
Se dice que los aminoácidos son anfolitos o anfóteros, pues tienen la capacidad de comportarse como bases o como ácidos; esta capacidad los faculta para actuar como amortiguadores del pH.
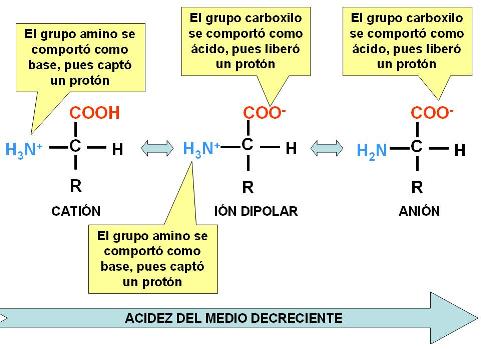 |
El grupo R o Radical de los aminoácidos es diferente para cada uno de ellos. Existen 20 radicales diferentes; por lo tanto, 20 clases de aminoácidos distintos forman las proteínas.
Si bien los 20 aminoácidos son necesarios, hay 8 de ellos que la especie humana no puede sintetizar y debe adquirir con la alimentación; son los llamados aminoácidos esenciales.
Según la composición de sus radicales, los aminoácidos se clasifican en apolares, polares con densidad de carga y polares con tendencia a ionizarse, es decir, con tendencia a adquirir carga neta. Entre los últimos están los aminoácidos básicos y los ácidos, que son los que llevan otro grupo amino o carboxilo, respectivamente, en su radical.
Enlace peptídico Regresar
Es el enlace que establecen entre sí los aminoácidos. El enlace peptídico se produce al reaccionar el grupo amino de un aminoácido con el grupo carboxilo de otro aminoácido. Los aminoácidos así combinados se llaman restos o residuos de aminoácidos.
Al formarse la unión peptídica se desprende una molécula de agua. De manera que la reacción en la cual se enlazan los aminoácidos es una condensación. La inversa, en la cual el enlace peptídico se rompe y se obtienen aminoácidos libres, es una hidrólisis.
Péptidos Regresar
Una cadena que contiene dos o más residuos de aminoácidos es un péptido. Hasta diez residuos se la llama oligopéptido y por encima de diez residuos, polipéptido. Una proteína es un polipéptido de alto peso molecular, pero el límite entre ambos es arbitrario y varía según los autores.
Los péptidos presentan dos extremos distintos: el N-terminal y el C-terminal. El N-terminal es el que tiene un residuo de aminoácido con grupo amino libre; este residuo es considerado el primero de la cadena. El extremo C-terminal es el que tiene un residuo de aminoácido con el grupo carboxilo libre; éste es considerado el último residuo de la cadena.
Niveles estructurales de las proteínas Regresar
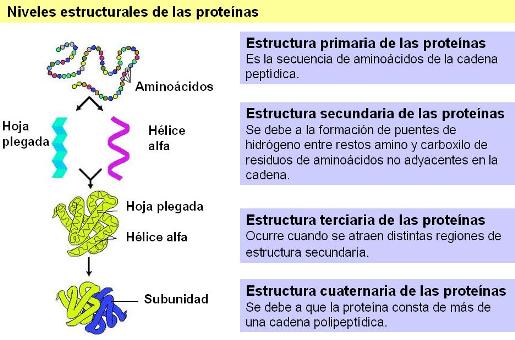
Todas las proteínas son cadenas de alto peso molecular formadas por residuos de aminoácidos. ¿En qué se diferencia una proteína de otra? Las proteínas se diferencian, en primer lugar, por el número, tipo y orden de los aminoácidos que constituyen su cadena. La secuencia de aminoácidos que presenta una proteína particular se denomina estructura primaria.
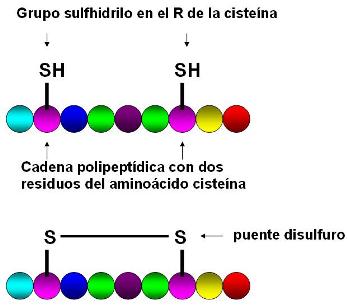 |
En algunas proteínas hay más de un residuo del aminoácido cisteína, que lleva un grupo sulfhidrilo en su radical. Dos residuos de cisteína pueden establecer una unión covalente entre los átomos de azufre, el puente disulfuro. La posición de los puentes disulfuro, cuando están presentes, forma parte de la estructura primaria.
Además de una secuencia particular de aminoácidos, las proteínas se pliegan sobre sí mismas, adoptando una estructura espacial determinada, o conformación nativa. Cada proteína adopta siempre la misma conformación nativa, si las condiciones del medio lo permiten. Esto indica que la forma de una proteína depende de su estructura primaria.
El primer nivel de plegamiento de una proteína es su estructura secundaria. La estructura secundaria puede ser regular, como la alfa hélice o la hoja plegada beta, o no seguir un patrón regular, en cuyo caso es de tipo aleatoria.
Las estructuras secundarias se originan porque se establecen uniones puentes de hidrógeno entre los restos amino y carboxilo de aminoácidos que están relativamente distantes en la estructura primaria, produciendo así un acercamiento entre ellos.
La estructura terciaria es la disposición global que adoptan en el espacio las distintas regiones de una proteína, después de haber adquirido su estructura secundaria. Esta disposición depende de interacciones que se establecen entre radicales, en general bastante alejados en la estructura primaria. Entre dichas interacciones se cuentan: uniones iónicas, puentes de hidrógeno, interacciones hidrofóbicas (todas ellas uniones no covalentes) y puentes disulfuro.
Algunas proteínas tienen estructura cuaternaria. Esta estructura se alcanza cuando la proteína está formada por dos o más cadenas polipeptídicas unidas entre sí por uniones no covalentes entre los radicales. A cada una de las cadenas que constituyen la proteína se le da el nombre de protómero o subunidad. Las proteínas de estructura cuaternaria también se conocen como proteínas oligoméricas.
 |
Desnaturalización Regresar
La desnaturalización es la destrucción de la conformación nativa de una proteína, sin que se vea afectada su estructura primaria. La proteína conserva la cadena, pero no su estructura espacial. Cuando una proteína se desnaturaliza, la función biológica se pierde, ya que ésta se halla estrechamente ligada a la forma.
Dado que la conformación nativa de una proteína está sostenida por uniones relativamente débiles, muchos agentes son capaces de afectarla, por ejemplo: calor, radiaciones, congelamientos repetidos, grandes presiones, ácidos o bases muy concentrados que provocan marcados cambios de pH, algunos solventes orgánicos, etc.
Funciones de las proteínas Regresar
Las proteínas desempeñan infinidad de funciones: hormonal, de sostén, contráctil, de transporte, de defensa, regulación genética, recepción de señales, enzimática y muchas otras. También pueden ser oxidadas para la producción de energía (rinden 4 Kcal/g) aunque no se reservan con este fin.
Todos hemos oído hablar de la información genética y se sabe que esta información, guardada en las moléculas de ADN, es la responsable de las características de un organismo y de las diferencias entre una planta y un perro, o entre dos personas. Lo que no todos saben es que la información que guarda el ADN es la información para fabricar proteínas. No heredamos el color de pelo, o la estatura, heredamos recetas con las instrucciones para elaborar determinadas proteínas. Luego, las proteínas son las encargadas de dotar al organismo de su estructura, su función y sus características propias.
Enzimas Regresar
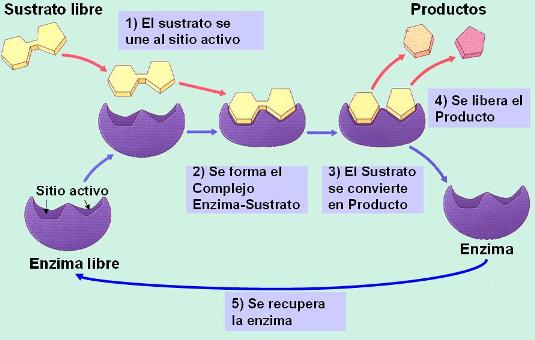
Las enzimas son proteínas de estructura terciaria o cuaternaria que cumplen la función de catalizadores biológicos, acelerando las reacciones químicas del metabolismo. Las enzimas hacen que la velocidad de las reacciones sea compatible con la vida. Sin enzimas, no existiría el metabolismo.
El mecanismo de acción de las enzimas ha sido explicado mediante el modelo de llave-cerradura. Cada enzima presenta un sitio (como un bolsillo en la estructura de la molécula) llamado sitio activo, donde encajan los sustratos de las reacciones químicas, tal como una llave encaja en su cerradura. La unión del sustrato al sitio activo facilita la formación del producto. Una vez formado, el producto se libera del sitio activo y la enzima se recupera sin cambios.
Este mecanismo de acción explica algunas propiedades de las enzimas: actúan a muy bajas concentraciones y son específicas.
Actúan a muy bajas concentraciones debido a que su estructura no resulta alterada al finalizar la reacción y, por lo tanto, la misma molécula de enzima puede catalizar sucesivas reacciones.
Son específicas: dado que la catálisis requiere el ingreso del sustrato al sitio activo, el sustrato y la enzima no solo deben tener afinidad química, sino también una forma complementaria. La misma enzima, en general, no admite sustratos distintos, como una cerradura no admite diferentes llaves.
Otra propiedad muy importante de las enzimas es que son regulables: ciertas sustancias pueden actuar como moduladores de la actividad enzimática, acrecentándola o disminuyéndola. También existen mecanismos como “interruptores” que pueden “encender” o “apagar” una enzima, controlando así el metabolismo por medio de su actividad.
Por último, se debe tener en cuenta que las enzimas son proteínas. Esto las hace pasibles de ser afectadas por distintos agentes desnaturalizantes. Una enzima desnaturalizada pierde su capacidad de catalizador, es decir, pierde su función específica.
 |
Existen reglas emanadas de la Unión Internacional de Bioquímicos para la clasificación y nomenclatura de las enzimas. Sin embargo, nosotros las mencionaremos por sus nombres comunes. El sufijo “asa” identifica el nombre de una enzima. Por ejemplo, el nombre común de la enzima del esquema es “sacarasa”.
|
|
