COMPOSICION
QUIMICA DE LOS SERES VIVOS
Sergio D. Ifrán - Nancy E. Fernández – Viviana Sabbatino - Silvia Márquez
INTRODUCCIÓN
Estructura atómica
La materia está formada por partículas del orden de 10 -10m llamadas átomos. Los átomos están formados por partículas subatómicas: protones, neutrones y electrones, distribuidos en dos zonas: el núcleo y la corteza del átomo.
En el núcleo se ubican los protones y los neutrones. Ambas partículas tienen una masa similar, que se mide en unidades de masa atómica (1 unidad de masa atómica = 1 u.m.a). La masa de estas partículas equivale a 1 unidad de masa atómica. Los protones tienen carga eléctrica, de signo positivo e intensidad 1. Los neutrones, en cambio, carecen de carga eléctrica.
Los electrones poseen una masa mucho menor, igual a la 1840 ava parte de la masa de un protón o neutrón, por eso la misma no es tomada en cuenta. La carga eléctrica de un electrón es de igual intensidad a la carga del protón, pero de signo opuesto, negativo. El número de electrones de un átomo coincide con el número de protones, de manera que las cargas positivas y negativas de un átomo se hallan balanceadas, haciendo de este una partícula eléctricamente neutra.
Cuadro 2.1- Partículas subatómicas |
|
|
Protón |
Neutrón |
Electrón |
| Ubicación en el átomo |
Núcleo |
Núcleo |
Corteza |
| Masa |
1 uma |
1 uma |
Despreciable |
| Carga eléctrica |
1+ |
0 |
1- |
Los electrones se ubican fuera del núcleo, en la corteza atómica. Uno de los primeros modelos representativos del átomo comparaba a este con un sistema solar: el núcleo atómico como la estrella central y los electrones como los planetas, ya que estos giran alrededor del núcleo, como los planetas lo hacen alrededor del sol. Sin embargo, este modelo fue reemplazado posteriormente, debido a que los electrones no se mueven describiendo órbitas planas, como los planetas, sino que lo hacen en nubes o zonas tridimensionales que rodean al núcleo, a las cuales se les dio el nombre de orbitales. Existen orbitales de diferentes formas, designados con las letras s, p, d y f. Un orbital se define como una zona donde es máxima la probabilidad de encontrar a un electrón en un momento dado.
|
Fig. 2.1- Modelo atómico de Rutherford (1911) |
La mayor parte del átomo es espacio vacío. Si se agrandara un átomo hasta llevarlo al tamaño de un estadio de fútbol, el núcleo ocuparía lo que una pelota de tenis en el centro de la cancha y los electrones, casi 2.000 veces menores que el núcleo, girarían en las tribunas.
Los electrones de un átomo son atraídos por las cargas positivas que se concentran en el núcleo. Cuanto mayor es la energía que posee un electrón, mayor es la fuerza para resistir a la atracción que sobre él ejercen las cargas positivas, y por lo tanto, mayor es la distancia que lo separa del núcleo. Así, los electrones se ubican en diferentes capas o niveles electrónicos; los que poseen menos energía se encuentran en los niveles más internos y los que poseen más energía en los niveles exteriores.
|
Fig.2.2- Diagrama del modelo atómico de Bohr (1913) |
Dado que partículas de igual carga se repelen, los niveles electrónicos no pueden albergar un número indefinido de electrones. Por el contrario, cada nivel tiene un número máximo de electrones admisible. Éste puede calcularse con la siguiente fórmula:
Número máximo de electrones admitidos = 2.n2, donde n = número del nivel.
Ej.:
Para el nivel 1 -> 2.12 = 2
Para el nivel 2 -> 2.22 = 8
En conclusión, los electrones giran alrededor del núcleo dentro de los orbitales, en distintos niveles energéticos. Cada orbital puede albergar hasta dos electrones. Un nivel incluye distintos tipos de orbitales, que se agrupan en subniveles. En la siguiente tabla se resumen los cuatro primeros niveles electrónicos, con sus correspondientes subniveles, orbitales y número máximo de electrones admitidos.
La configuración electrónica es la distribución que adoptan los electrones de un átomo particular. Los electrones de un átomo se distribuyen siempre ocupando los orbitales en un orden fijo, desde el de menor al de mayor nivel energético. Es decir que, conociendo el número de electrones de un átomo, podemos predecir su configuración electrónica.
En la siguiente figura puede verse una representación de los orbitales de cada subnivel, en orden creciente de energía desde abajo hacia arriba. Nótese, por ejemplo, que los orbitales del subnivel 4s tienen menos energía que los del 3d; esto implica que se poblarán antes.
|
Fig. 2.3-Niveles electrónicos |
¿Cómo recordar el orden de “llenado” de los orbitales? Éste se puede obtener aplicando una regla práctica, la “regla de las diagonales”, que se muestra a continuación. Siguiendo el recorrido de las diagonales es posible determinar la posición que ocuparán los electrones.
|
Fig. 2.4- Reglas de las diagonales (Diagrama de Moeller) |
Por ejemplo, un átomo que posee 7 electrones presenta 2 electrones en el nivel 1 y 5 electrones en el nivel 2, con la siguiente distribución: 1s2, 2s2, 2p3.
Elemento químico
Un átomo puede ser caracterizado por su número atómico y su número másico.
El número atómico o Z es el número de protones de un átomo.
Como las propiedades de un átomo dependen de su número de protones, todos los átomos con igual número atómico (o igual Z) tienen las mismas propiedades.
Así, se define elemento químico como el conjunto de átomos con el mismo número atómico. Los elementos químicos conocidos, entre los naturales y los obtenidos artificialmente, son algo más de cien. A cada uno de ellos se le asigna un nombre y un símbolo químico. Este último consiste en la inicial del nombre latino, en mayúscula, o bien la inicial más una o dos letras, en minúscula, cuando es necesario diferenciar elementos que tienen la misma inicial.
El número másico o A indica la masa que presenta un átomo y resulta de la suma del número de protones y el número de neutrones del mismo.
Z y A pueden anotarse como subíndice y supraíndice, respectivamente, a la izquierda del símbolo del elemento.
Ejemplo:
Elemento = Hidrógeno
Símbolo químico = H
Z = 1
A = 1
Isótopos
Suele ocurrir que átomos del mismo elemento poseen distinto número de neutrones, por ejemplo, los átomos de Hidrógeno pueden tener 1, 2 o ningún neutrón, por lo cual difieren en su número másico; estos átomos se denominan isótopos. En estos casos, el número másico del elemento se calcula como promedio de los distintos isótopos, según los porcentajes de los mismos presentes en la naturaleza (por eso A puede no ser un número entero).
Es interesante señalar que algunos isótopos son radiactivos. Los seres vivos no distinguen entre el isótopo radiactivo y el no radiactivo de un cierto elemento, utilizando indistintamente uno u otro, conforme a la proporción en que se hallan disponibles en el ambiente.
En biología, los isótopos radiactivos de algunos elementos resultan muy útiles como trazadores, por cuanto la posibilidad de detectar la radiación que emiten permite trazar el itinerario del isótopo dentro del organismo o su participación en distintas reacciones químicas.
Ciertos isótopos son utilizados como datadores, ya que posibilitan calcular la edad de restos fósiles o estratos geológicos.
En medicina, los isótopos radiactivos de distintos elementos son empleados en ciertas técnicas de diagnóstico y tratamiento.
Tabla periódica de los Elementos
Los elementos químicos están ordenados en la tabla periódica de los elementos. Allí se representan con su nombre y símbolo químico, siguiendo un orden creciente de sus números atómicos. En la tabla periódica, los elementos se agrupan horizontalmente en filas, llamadas períodos, y verticalmente, en columnas llamadas grupos. Todos los elementos del mismo período tienen la misma cantidad de niveles electrónicos. Todos los elementos del mismo grupo, en cambio, poseen el mismo número de electrones en su último nivel electrónico. Esto, como se verá seguidamente, determina que su comportamiento químico sea similar.
Molécula y sustancia
Los átomos de la mayor parte de los elementos no se encuentran al estado libre en la naturaleza. Por el contrario, los átomos tienden a unirse unos con otros formando partículas denominadas moléculas. Las fuerzas que mantienen juntos a los átomos de una molécula reciben el nombre de uniones o enlaces químicos.
Los relativamente pocos elementos naturales dan lugar a la existencia de una gran cantidad de materiales con propiedades diferentes y características, debido a la tendencia de los átomos a combinarse unos con otros, formando diferentes tipos de moléculas. Las propiedades de la materia cambian de acuerdo con la composición y estructura de las moléculas que la forman. Así, átomos del elemento Oxígeno pueden formar el gas oxígeno cuando se combinan de a dos, el gas ozono, cuando se combinan de a tres o agua, cuando se combinan con átomos del elemento Hidrógeno. El gas oxígeno, el gas ozono y el agua son ejemplos de sustancias.
|
Fig. 2.7-Ejemplos de sustancias |
Una sustancia puede definirse como una clase particular de materia, con propiedades características y constantes, derivadas de una determinada estructura molecular. La molécula es la menor partícula que conserva las propiedades de una sustancia; si la molécula se rompe, si sus átomos se separan, o se unen de manera diferente, la sustancia original da paso a otras, con otras propiedades.
Algunas sustancias, llamadas sustancias elementales, están formadas por átomos de un solo elemento (tal es el caso del gas oxígeno). Otras, llamadas compuestos químicos, constan de más de un elemento (por ejemplo, el agua).
La fórmula molecular de una sustancia es la representación simbólica de la composición de una molécula; en ella se especifica el tipo y número de átomos que la forman. En una fórmula molecular se escriben los símbolos de los elementos que componen la molécula; si hay más de un átomo de cada elemento, se indica el número correspondiente como un subíndice a la derecha del símbolo.
Peso atómico (PA) y Peso molecular (PM)
La masa del átomo se calcula sumando la masa de sus protones y neutrones. La masa de una molécula es igual la sumatoria de las masas respectivas de los átomos que la forman.
Si bien masa y peso son magnitudes distintas, a fines prácticos, el peso atómico y el peso molecular coinciden con el valor de las respectivas masas. El peso molecular se expresa en la unidad “Dalton” (Da) que equivale al peso de un átomo de hidrógeno.
Mol
El mol es una unidad muy utilizada que equivale a 6,02 .1023 (número de Avogadro) partículas elementales (protones, neutrones, electrones, átomos, moléculas o iones). La masa de un mol de partículas corresponde a la masa de una partícula expresada en gramos. Por ejemplo, la masa molecular del agua es 18, entonces un mol de moléculas de agua tiene una masa de 18 g.
Reacción y ecuación química
Las reacciones químicas son las transformaciones en las cuales una o más sustancias cambian su estructura molecular, convirtiéndose en otras. Las sustancias iniciales se denominan reactivos o sustratos y las finales, productos.
Durante una reacción química ordinaria, los átomos no se destruyen ni se crean, solamente se reordenan, de allí que el átomo sea definido como “la menor partícula capaz de participar en una reacción química”.
Las reacciones químicas se representan mediante las ecuaciones químicas. Una ecuación química tiene dos miembros: el primero corresponde a los reactivos y el segundo corresponde a los productos. Ambos miembros están conectados por una flecha que va desde los reactivos hacia los productos. Como la cantidad de átomos de cada elemento se conserva a lo largo de la reacción, para mantener la igualdad de ambos miembros es necesario “balancear” las ecuaciones, colocando los coeficientes que correspondan a cada sustancia interviniente.
|
Fig. 2.8- Reacción y ecuación químicas |
Uniones químicas
Si bien la mayoría de los elementos tienden a combinarse unos con otros, los elementos clasificados en el grupo VIII de la tabla, llamados gases raros, nobles o inertes, son una excepción. Estos no reaccionan, por lo cual sus átomos se encuentran al estado libre en la naturaleza. Los químicos buscaron en la configuración electrónica de los gases nobles la explicación a su inercia, o incapacidad de reaccionar. Encontraron que los gases nobles tienen su último nivel electrónico completo, esto es: con el número máximo de electrones admisible para ese nivel. El resto de los elementos, pertenecientes a otros grupos de la tabla periódica, posee su último nivel incompleto. Concluyeron, entonces, que lo que determina que un átomo sea inestable y reaccione con otros es la “necesidad” de completar su nivel electrónico más externo. Al formar una unión química, un átomo inestable “consigue” el número de electrones que le confiere la estabilidad. Esta explicación se conoce como “teoría del octeto de Lewis”, dado que, en muchos casos, ocho es el número de electrones del último nivel con el cual un átomo se hace estable. Cuando un átomo se enlaza con otro tiende a adquirir la configuración electrónica del gas noble más cercano en la tabla periódica.
Los electrones de la última capa electrónica de un átomo, responsables de la reactividad química del mismo, se denominan electrones de valencia (estos no deben confundirse con el “número de valencia” que definiremos más adelante).
Las uniones o enlaces químicos interatómicos se clasifican en dos tipos fundamentales: iónicos y covalentes. Los enlaces covalentes pueden ser polares o apolares.
El tipo de enlace que se establezca entre los átomos depende de una propiedad llamada electronegatividad. La electronegatividad mide la capacidad de un átomo de atraer electrones. Cada elemento tiene un valor de electronegatividad (que figura en la tabla periódica). La diferencia de electronegatividad entre los átomos que interaccionan (pequeña, intermedia o alta) determina el enlace que se establece entre ellos, según la siguiente escala:
|
Cuadro 2.3- Diferencia de electronegatividad y tipo de enlace |
Unión iónica
Las uniones iónicas ocurren cuando reaccionan un metal, como el sodio, y un no metal, como el cloro. Los metales son elementos con baja electronegatividad (son electropositivos) y tienen tendencia a ceder electrones, mientras que los no metales tienen una electronegatividad alta (son electronegativos) y tienen tendencia a captar electrones.
Al encontrarse un átomo de sodio con uno de cloro, este atrae el electrón de valencia del sodio. Así, el cloro adquiere el electrón que le falta para estabilizar su nivel 3. Al mismo tiempo, el sodio, despojado de su electrón, queda con dos niveles electrónicos. Ahora, su nivel 2 pasa a ser el más externo, quedando estabilizado con sus 8 electrones. Como consecuencia de la cesión de un electrón del sodio al cloro, tanto uno como otro se convierten en iones. Un ión es una partícula con carga eléctrica. El sodio se transforma en un catión (ión con carga positiva), pues conserva sus 11 protones, pero posee solamente 10 electrones. El cloro, por su parte, queda convertido en un anión (ión con carga negativa), pues posee 17 protones y 18 electrones.
Como las partículas de carga opuesta se atraen, el catión sodio y el anión cloruro (nombre del anión derivado del cloro) permanecen juntos, formando un compuesto iónico: la sal cloruro de sodio (sal de mesa). La fuerza que los mantiene unidos se denomina enlace iónico.
|
| Fig. 2.9-Enlace iónico en el NaCl |
Unión covalente
A diferencia de los enlaces iónicos, en los cuales un átomo cede electrones y otro los capta, en los enlaces covalentes los átomos comparten pares de electrones. Por ejemplo, los átomos de Hidrógeno que forman las moléculas de H2 (gas hidrógeno) establecen entre sí una unión covalente.
Para esquematizar una unión covalente, es útil el diagrama de Lewis, que consiste en representar el núcleo y las capas electrónicas interiores de un átomo mediante su símbolo químico, y dibujar a su alrededor los electrones de valencia, escogiendo para ello un signo como punto, cruz u otros.
Dado que los átomos de Hidrógeno poseen 1 electrón en su nivel 1, alcanzan la estabilidad con 2 electrones, que es el número máximo admitido por ese nivel, adoptando así la estructura del Helio, el gas noble más cercano (Z =2). A cada átomo le falta un electrón para estabilizarse, pero como tienen la misma electronegatividad, el electrón no es cedido por ninguno de ellos. Por lo tanto, se forma un par de electrones que se comparte entre ambos núcleos. El par de electrones compartido mantiene juntos y estables a los átomos formando una unión covalente.
|
Fig. 2.10-Unión covalente en el H 2 |
En el caso del gas oxígeno (O2), los átomos que forman la molécula comparten dos pares de electrones, dado que los átomos de Oxígeno tienen 6 electrones de valencia en el nivel 2, el cual se satisface con 8 electrones.
|
Fig. 2.11-Unión covalente en el O2 |
Como se desprende de los casos anteriores, en las uniones covalentes pueden ser compartidos uno o más pares de electrones, lo que permite clasificarlas en simples, dobles, etc.
La unión covalente simple entre los átomos de Hidrógeno del H2 y la unión covalente doble entre los átomos de Oxígeno del O2 son uniones covalentes apolares o no polares. Se denomina así a las uniones en las cuales los pares de electrones compartidos son atraídos con la misma fuerza por los núcleos que los comparten, de manera que los electrones no tienden a acercarse más a un núcleo que al otro, sino que se reparten equitativamente entre ambos. Esto ocurre cuando los átomos que establecen la unión covalente pertenecen al mismo elemento, o sea que tienen la misma electronegatividad, pero también puede darse entre elementos diferentes, por ejemplo entre Carbono e Hidrógeno, siempre que la diferencia de electronegatividad entre ellos sea pequeña. Las sustancias formadas por moléculas cuyos enlaces interatómicos son covalentes apolares, se conocen como sustancias apolares.
|
Fig. 2.12-Unión covalente apolar en el metano |
En algunos casos, los enlaces covalentes se establecen entre átomos de elementos con diferencia de electronegatividad intermedia: ni tan acentuada como para producir la ionización, ni tan pequeña como para generar un enlace covalente apolar, en el cual los electrones compartidos están a igual distancia de ambos núcleos. En estos casos ocurren uniones covalentes polares. En las uniones covalentes polares, cada átomo aporta un electrón para formar el par que se comparte, pero este resulta atraído más fuertemente por uno de los dos átomos, el que corresponde al elemento con mayor electronegatividad. Así, los electrones tienden a ubicarse en un polo de la molécula, generando una zona de densidad eléctrica negativa (δ-), mientras que el otro polo de la molécula queda desprovisto de electrones, convirtiéndose en un polo de densidad eléctrica positiva (δ+). Las moléculas en las cuales hay uniones covalentes polares son dipolos, y las sustancias por ellas formadas son compuestos polares. Es importante diferenciar un compuesto polar de un ión. En el compuesto polar, la cantidad total de cargas positivas (protones) y negativas (electrones) está balanceada, aunque la densidad de electrones sea mayor en una parte de la molécula. Un ión, en cambio, es una partícula que cedió o ganó uno o más electrones, por lo cual sus cargas positivas y negativas no están balanceadas y se dice que tiene carga neta (negativa o positiva).
El oxígeno, por ser un elemento muy electronegativo, forma uniones covalentes polares con otros elementos menos electronegativos, como el carbono o el hidrógeno. En el siguiente esquema se analiza la formación de los enlaces covalentes polares entre el oxígeno y el hidrógeno que dan origen a la molécula de agua, compuesto polar de importancia fundamental para los seres vivos.
|
Fig. 2.13- Unión covalente polar en el H2O |
Como se observa en el esquema, los dos pares de electrones compartidos entre ambos elementos resultan atraídos con mayor fuerza por el átomo de oxígeno, donde se establece el polo de densidad negativa de la molécula; la zona de densidad positiva corresponde a los núcleos de los átomos de hidrógeno.
En todas las uniones covalentes mencionadas hasta el momento, el par de electrones que se comparte se conforma con un electrón proveniente de cada átomo. A estas uniones se las llama covalentes puras. Existe otro tipo de unión covalente: la dativa o coordinada. Esta se diferencia de la anterior en que el par de electrones es aportado por uno solo de los átomos participantes. De modo que un átomo contribuye como dador de los electrones y el otro como aceptor, aunque los electrones son compartidos. Por ejemplo, en el dióxido de azufre (SO2), uno de los átomos de oxígeno establece unión covalente pura doble con el átomo de azufre (Z=16), de manera que ambos consiguen 8 electrones en su nivel electrónico externo. El segundo átomo de oxígeno también comparte un par de electrones con el átomo de azufre, pero en este caso los dos electrones los aporta el azufre, formándose una unión covalente dativa.
|
Fig. 2.14-Unión covalente dativa |
El siguiente cuadro resume las características de los distintos tipos de uniones descriptas previamente.
|
Cuadro 2.5- Resumen de las uniones químicas interatómicas |
Valencia
El número de valencia o simplemente la valencia de un elemento químico es el poder o capacidad de combinación que este tiene con respecto a otro, es decir, el número de uniones que puede establecer. Si se tratare de uniones covalentes, la valencia es el número de pares electrónicos que comparte, y si se tratare de uniones iónicas, el número de electrones que cede o recibe.
Uniones intermoleculares: fuerzas de van der Waals
Entre todas las moléculas de cualquier sustancia existe una débil atracción que se torna significativa cuando la distancia entre las moléculas es muy pequeña. Este tipo de atracción o unión intermolecular se conoce como fuerza de van der Waals. Es debida a que la atracción mutua entre el núcleo de una molécula y los electrones de otra, es ligeramente superior a la repulsión mutua entre los electrones y los núcleos de ambas. Por regla general, las moléculas pesadas se atraen con mayor intensidad que las livianas.
QUÍMICA DE LOS SERES VIVOS
Los seres vivos estamos formados por materia, con un alto grado de organización. En la composición química de los seres vivos, más del 90% del peso de los mismos está representado tan solo por cuatro elementos, los bioelementos principales: Oxígeno, Carbono, Hidrógeno y Nitrógeno, con las contribuciones que se especifican a continuación.
|
Cuadro 2.6- Porcentaje de los bioelementos principales en los seres vivos |
Los cuatro bioelementos principales son los componentes primordiales de las sustancias orgánicas, así llamadas porque en la naturaleza se encuentran como producto de la actividad de los organismos vivos. Las sustancias orgánicas de mayor importancia en los seres vivos se agrupan en cuatro familias: los glúcidos o hidratos de carbono, los lípidos, las proteínas y los ácidos nucleicos.
Los seres vivos también contienen sustancias inorgánicas, entre ellas, la más abundante de todas, el agua, que representa alrededor del 70% del peso corporal. Además del agua, otros minerales forman en conjunto entre el 4 y el 5% del peso corporal. Los macrominerales, o minerales más abundantes, son el Calcio, el Fósforo, el Magnesio, el Sodio, el Cloro, el Potasio y el Azufre. Entre los microminerales, también llamados oligoelementos, por su pequeña proporción en el organismo, se encuentran: Hierro, Zinc, Cobre, Yodo, Fluoruro, Manganeso, Cromo, Cobalto, Selenio y Molibdeno.
|
Fig. 2.15- Composición química de los seres vivos |
Agua
El agua: puentes de hidrógeno, cohesión molecular y propiedades del agua
El agua es la sustancia más abundante en los seres vivos. Si bien es una sustancia muy común, debido a su abundancia, no es una sustancia ordinaria, pues reúne una serie de propiedades que la hacen especial y determinan el papel que desempeña en los organismos.
Las moléculas de agua (H2O) están formadas por un átomo de oxígeno ligado a dos átomos de hidrógeno, que quedan separados entre sí por un ángulo de 105º.
|
Fig. 2.16-Molécula de agua |
El agua es un compuesto polar: los enlaces entre oxígeno e hidrógeno son uniones covalentes polares. La diferencia de electronegatividad entre estos dos elementos hace que las cargas positivas y negativas no se distribuyan de manera uniforme, sino asimétricamente, formando polos o zonas de densidad eléctrica positiva y negativa. Al compartir sus electrones con el oxígeno (muy electronegativo), los dos átomos de hidrógeno dejan sus núcleos virtualmente desnudos. Dado que cada núcleo de hidrógeno es un protón, quedan así dos cargas positivas expuestas. Estas cargas positivas ejercen una fuerza de atracción sobre cualquier electrón no compartido. Como puede observarse en la representación de Lewis de la molécula de agua, el átomo de oxígeno posee dos pares de electrones no compartidos. Por lo tanto, las moléculas de agua se atraen unas a otras; los hidrógenos de una molécula se unen a los electrones desapareados de los átomos de oxígeno de otras moléculas. Cada molécula de agua presenta cuatro de estos sitios de unión, dos positivos (los núcleos de los hidrógenos) y dos negativos (los pares de electrones no compartidos del oxígeno). Es decir que una molécula de agua puede unirse de esta manera a otras cuatro.
|
Fig. 2.17-Puentes de H entre moléculas de agua |
Las uniones así formadas son un tipo de unión intermolecular denominado unión puente de hidrógeno. Dichas uniones no ocurren solamente entre las moléculas de agua, sino que se producen entre muchos compuestos diferentes, siempre que estos sean polares.
Las uniones puente de hidrógeno son enlaces más débiles que los enlaces interatómicos, como los covalentes o los iónicos; sin embargo, en conjunto, ejercen una influencia muy importante, tanto en las propiedades del agua como en otras sustancias que forman parte de los seres vivos.
La capacidad de las moléculas de agua para formar puentes de hidrógeno entre sí es responsable de la fuerte unión o cohesión molecular que se verifica entre ellas. La alta cohesión de las moléculas de agua explica muchas de sus propiedades, tales como: altos puntos de fusión y ebullición, flotabilidad del hielo, alto calor de vaporización, alto calor específico y alta tensión superficial.
Es sabido que el agua se presenta en estado natural en nuestro planeta, al mismo tiempo y en abundancia, en tres estados: sólido, líquido y gaseoso, mientras que otras sustancias permanecen en uno solo de estos estados (aunque en otra parte del universo, o en condiciones de laboratorio sea factible el cambio de fase).
Recordemos que un sólido se caracteriza por su forma y volumen propios; un líquido no tiene forma propia, pero sí un volumen definido; mientras que un gas no tiene forma ni volumen propios, sino que adopta los del recipiente que lo contiene. El estado físico o de agregación depende de las fuerzas de atracción y repulsión que hay entre las partículas que forman una sustancia. Si predominan las fuerzas de atracción, el estado es sólido, si predominan las de repulsión, el estado es gaseoso y si ambos tipos de fuerza están equilibrados, el estado es líquido.
Los estados de agregación son función de la temperatura y se suceden unos a otros a medida que la temperatura aumenta o disminuye en una sustancia dada. Si se eleva la temperatura de un sólido, hasta un determinado punto (punto de fusión) éste funde, convirtiéndose en líquido. Si se aumenta después la temperatura del líquido hasta cierto valor (punto de ebullición), entra en ebullición; más allá de este punto, la sustancia pasa al estado gaseoso. La temperatura es una medida del grado de agitación de las partículas que forman una sustancia, y por eso aumenta cuando estas absorben calor, que es una forma de energía.
Ahora volvamos al agua. A una presión de 1 atm, su punto de fusión es de 0º C y su punto de ebullición de 100º C. Cuando se la compara con sustancias análogas, pero de mayor peso molecular, como el H2S, los valores correspondientes al agua resultan extremadamente más altos de lo esperado (los valores para el H2S son - 64º C y – 42º C, respectivamente). ¿Por qué los puntos de fusión y ebullición del agua son tan altos? Por los puentes de hidrógeno. Llevar al agua desde el estado sólido al líquido o de éste al gaseoso, requiere una gran cantidad de energía para liberar a las moléculas, ligadas entre sí por los puentes de hidrógeno. En conclusión, los puentes de hidrógeno son la causa de que el agua se encuentre en sus tres fases dentro de los límites de temperatura y presión naturales en la Tierra. De no ser por los puentes de hidrógeno se esperaría que el agua fundiera a -100º C y entrara en ebullición a -80º C, lo cual haría imposible la vida tal como la conocemos.
Al estado sólido, cada molécula está unida a otras cuatro mediante sendos puentes de hidrógeno, extendidos hacia cuatro direcciones del espacio separadas por ángulos de 105 º. Esta disposición determina la forma de un tetraedro, tal es la estructura cristalina del hielo. El cambio al estado líquido implica la ruptura de muchos puentes, que se hacen más transitorios, es decir que se rompen y vuelven a formarse entre otras moléculas con mucha rapidez. Al estado gaseoso, la mayor parte de los puentes desaparece, pero aún se conservan algunos de ellos.
|
Fig. 2.18- Estados del agua |
Por regla general, toda sustancia, sea en estado sólido, líquido o gaseoso, se contrae o disminuye su volumen al enfriarse. El agua también sigue esta regla dentro de un amplio intervalo de temperatura. Partiendo de 100º y hasta llegar a 4º C el volumen disminuye en forma continua. A partir de los 4º C y hasta el punto de congelación, el proceso se invierte: en lugar de seguir contrayéndose, el agua se dilata. Esto obedece a que, al disminuir los movimientos moleculares, los puentes de hidrógeno se fijan, congelando a las moléculas en una red en la que las distancias entre una y otra son mayores. En la red cristalina del hielo, las moléculas están más separadas unas de otras que al estado líquido. Caben más moléculas en 1 cm3 de agua líquida que en un 1 cm3 de hielo. Dicho en otros términos: la densidad o relación masa/volumen del agua líquida es mayor que la densidad del hielo.
La menor densidad del hielo con respecto al agua líquida hace que el hielo flote. ¿Qué pasaría si el agua se comportara como otras sustancias y el hielo fuera más denso que el agua líquida? Los mares, ríos y lagos se congelarían desde el fondo a la superficie y gran parte del agua dejaría de estar disponible para los seres vivos. En cambio, la flotabilidad del hielo permite la continuidad de la vida debajo de la capa superficial congelada de los cuerpos de agua.
Otra de las propiedades inusuales del agua es su alto calor específico. El calor específico se define como la cantidad de calor que hay que entregar a 1 gramo de una sustancia para elevar 1 grado su temperatura. Si las fuerzas de atracción entre las moléculas de una sustancia son débiles, al absorber calor, rápidamente entrarán en agitación, produciendo un aumento de la temperatura. Si por el contrario, las fuerzas de atracción son fuertes, deberá entregarse una cantidad mayor de energía calórica para que las moléculas se separen y aumenten sus movimientos, con el consiguiente aumento de temperatura. Este último es el caso del agua, cuyas moléculas se mantienen fuertemente cohesionadas por los puentes de hidrógeno. Por eso el agua puede absorber grandes cantidades de calor sin que su temperatura aumente en forma significativa, o entregar grandes cantidades de calor sin que su temperatura descienda abruptamente. Por ejemplo, si se coloca una olla vacía sobre el fuego, pronto se pondrá al rojo, pero si se la llena de agua, en el mismo lapso, la temperatura del agua sólo aumentará unos pocos grados. O la misma radiación solar impactando sobre el suelo arenoso y el agua, producirá un aumento de temperatura mucho más marcado sobre el suelo que sobre el agua. Un gramo de agua necesita 10 veces más calor que un gramo de hierro o 5 veces más calor que un gramo de arena para incrementar en el mismo valor su temperatura. Es decir, el agua tiene un calor específico igual a 10 veces el del hierro o 5 veces el de la arena. Con su alto calor específico, el agua posee un importante efecto moderador de la temperatura. Este efecto moderador no solo se pone en juego en el ambiente, sino también en el organismo, cuya mayor parte está constituida por agua.
A la capacidad termorreguladora del agua contribuyen también su alto calor de fusión y de vaporización. Siempre que la temperatura de un sólido aumenta hasta alcanzar su punto de fusión, o la de un líquido, hasta alcanzar su punto de ebullición, se produce un proceso de transición, durante el cual ambas fases (sólido y líquido o líquido y vapor) coexisten. En este lapso, hasta que la fusión o vaporización se completan, se absorbe calor sin que varíe la temperatura. El valor del calor absorbido, en el caso del agua, es muy alto. Cuando en los días de alta temperatura ambiente el cuerpo transpira, el agua eliminada vaporiza sobre la piel, tomando de esta el calor necesario para el proceso. Como el calor de vaporización es alto, este fenómeno contribuye a retirar gran parte del calor corporal, colaborando en la regulación de la temperatura del cuerpo.
La marcada tendencia a la cohesión del agua hace que esta tienda a “cerrarse” sobre sí misma. Por eso las gotas tienen forma esférica, ya que esta es la forma que ofrece menor superficie para un volumen dado. La fuerte cohesión provoca que la superficie del agua se comporte como una película o membrana. Esa fuerza resultante de la cohesión recibe el nombre de tensión superficial. Con excepción del mercurio, el agua posee la tensión superficial más elevada de todos los líquidos comunes.
La cohesión sumada a la adhesión (unión de las moléculas de agua a otras superficies sólidas) da por resultado el fenómeno de capilaridad. La capilaridad es la capacidad del agua de elevarse en forma de columna por tubos capilares (de diámetro delgado como un cabello). Este fenómeno está relacionado con el movimiento del agua en los suelos, el transporte por los vasos de conducción de las plantas y la circulación de la sangre.
|
Fig. 2.19- Propiedades del agua |
Capacidad disolvente del agua: sustancias hidrofóbicas, hidrofílicas y anfipáticas
Dado que el agua es la sustancia más abundante en el organismo, es de suma importancia entender cómo interacciona con las otras sustancias, orgánicas o inorgánicas, que forman parte de un ser vivo. Según el comportamiento que las sustancias tengan frente al agua, aquéllas pueden ser clasificadas en tres categorías: hidrofóbicas, hidrofílicas y anfipáticas.
El término hidrofóbica significa “que teme al agua”. Las sustancias hidrofóbicas son aquéllas que, debido a su estructura química, no tienen afinidad por el agua. Esto ocurre cuando la sustancia es apolar o no polar. Un ejemplo conocido es el del aceite y el agua. Cuando se incorpora aceite en un medio acuoso, este tiende a agruparse entre sí, “huyendo” del agua y ofreciendo la menor superficie de contacto posible. A ese comportamiento se lo denomina interacción hidrofóbica.
Las sustancias hidrofílicas son las que tienen “amor por el agua”. Se trata de compuestos con algún tipo de polaridad, ya sean iónicos (con carga neta) o polares sin carga neta, pero con densidad de carga. Este tipo de sustancias son atraídas por las moléculas de agua, también polares, que se mezclan con ellas formando distintas clases de sistemas dispersos: soluciones, dispersiones coloidales y suspensiones.
|
Cuadro 2.7- Sistemas materiales |
El agua interacciona con los compuestos iónicos, como el cloruro de sodio, formando soluciones iónicas. El cloruro de sodio es un compuesto cristalino en el cual los iones ocupan posiciones definidas, formando un retículo que se repite en las tres dimensiones del espacio. Los cationes Na+ y los aniones Cl- se alternan ocupando los vértices de cubos imaginarios, de manera que cada Na+ queda rodeado por 6 Cl- y cada Cl- queda rodeado por 6 Na+.
Cuando el agua se pone en contacto con los cristales de cloruro de sodio, los polos positivos de las moléculas de agua son atraídos por los iones Cl- mientras que sus polos negativos son atraídos por los iones Na+. Las moléculas de agua rodean a los iones formando a su alrededor una “capa de solvatación”. La mayor distancia entre catión y anión debilita la unión iónica, produciendo la disolución del cristal. Debido a este comportamiento del agua frente a las partículas con carga, la fuerza de atracción entre dos iones en el agua es sólo 1/80 de la fuerza que actuaría en el vacío. La capacidad del agua para separar iones es muy alta, y técnicamente esta propiedad se expresa como una “alta constante dieléctrica del agua”. El agua es, entonces, un excelente disolvente para los compuestos iónicos.
|
Fig. 2.20- Disolución del cloruro de sodio en agua |
Los compuestos covalentes polares se mezclan con las moléculas de agua estableciendo con ellas uniones puente de hidrógeno. La afinidad de estos compuestos polares por el agua se hace evidente cuando el agua “moja” determinadas superficies, por ejemplo las fibras de algodón (formadas por celulosa) o los componentes del suelo (arcillas).
Cuando las sustancias polares tienen PM relativamente bajos (las moléculas son pequeñas) se disuelven en agua, formando soluciones moleculares, sistemas homogéneos en los cuales las moléculas del soluto quedan rodeadas por las del solvente (agua) y enlazadas a ellas por medio de los puentes de hidrógeno. Por ejemplo, el alcohol fino (etanol) y los azúcares en general, entre ellos la sacarosa o azúcar de caña, se disuelven en agua de esta forma. Los puentes de hidrógeno se forman entre los átomos de oxígeno del agua y los átomos de hidrógeno del grupo hidroxilo (-OH) presente en estos compuestos.
Otras sustancias polares de mayor PM, como por ejemplo el almidón o ciertas proteínas, que son macromoléculas, se dispersan en agua formando sistemas heterogéneos, como las dispersiones coloidales o las suspensiones, ya que el tamaño de las partículas dispersas supera el límite de las soluciones. Los coloides o dispersiones coloidales pueden existir en dos estados, llamados estado de sol y estado de gel. En el estado de sol el agua actúa como fase dispersante. En el estado de gel, el sólido (macromolécula) forma redes en cuyos intersticios se ubican las moléculas de agua, es decir que éstas pasan a ser la fase dispersa.
|
Fig. 2.22- Estados de sol y gel |
Existen compuestos en los cuales una parte de la molécula es polar (con densidad de carga o incluso con carga neta), pero otra parte de la misma molécula es no polar. Por consiguiente, una parte de la molécula es afín al agua o hidrofílica, mientras que la otra rechaza al agua, es hidrofóbica. Cuando zonas hidrofílicas e hidrofóbicas conviven en la misma molécula, se dice que esta es una molécula anfipática (con ambos tipos de afinidad). Las moléculas anfipáticas tienen un comportamiento especial en medios acuosos, donde se disponen formando estructuras en forma de bicapas o micelas. Dichas estructuras son de gran importancia en la organización de las membranas y otros procesos biológicos y serán analizadas más adelante.
En el siguiente cuadro se resume la interacción del agua con distintos tipos de compuestos:
|
Cuadro 2.8- Capacidad disolvente del agua |
Es una expresión frecuente referirse al agua como “un solvente universal”. De lo recientemente expuesto se desprende que el agua no disuelve a todas las sustancias, pero sí que forma soluciones o dispersiones con una gran cantidad de ellas. Esta fuerte capacidad disolvente o dispersante del agua la convierte en el medio ideal para muchas funciones orgánicas. Por consiguiente, el agua;
- es el medio en el que otras sustancias se encuentran y reaccionan, es decir el medio en el que transcurre el metabolismo,
- es el vehículo de los nutrientes y otras sustancias en la sangre,
- es el disolvente de los productos de desecho excretados en la orina o el sudor.
Incluso lo que a primera vista pareciera un desventaja, como la incapacidad del agua de mezclarse con las sustancias hidrofóbicas, tiene útiles consecuencias, como veremos al tratar el tema de los depósitos grasos o la función biológica de la ceras, por citar algunos ejemplos.
Concentración
Los líquidos corporales son soluciones en las cuales es necesario mantener la concentración de determinados solutos dentro de ciertos valores, para que las funciones orgánicas se lleven a cabo adecuadamente.
Se entiende por concentración (c) de una solución a la relación existente entre la cantidad del soluto (st) y la cantidad del solvente (sv) o de la solución (sn).
Esta relación puede expresarse de distintas formas, por ejemplo:
 |
La molaridad, molalidad, osmolaridad y osmolalidad son formas de expresar la concentración en número de partículas disueltas y no en masa de partículas disueltas. Puesto que algunas propiedades de las soluciones dependen del número de partículas de soluto, estas formas de expresar la concentración son útiles en determinados contextos.
Ya hemos visto que un mol de partículas equivale 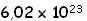 partículas. También sabemos que se puede realizar la conversión de moles a masa, pues un mol de una sustancia tiene una masa en gramos igual a su peso molecular. partículas. También sabemos que se puede realizar la conversión de moles a masa, pues un mol de una sustancia tiene una masa en gramos igual a su peso molecular.
Ahora bien, cuando el soluto es un compuesto iónico y el solvente es el agua, los iones se separan. Esto significa que si se coloca un mol de cloruro de sodio en agua, no habrá 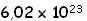 partículas disueltas, sino el doble, es decir, partículas disueltas, sino el doble, es decir, 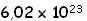 cationes sodio y cationes sodio y 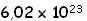 aniones cloruro. aniones cloruro.
Para contemplar situaciones como la anterior se utiliza el osmol.
Un osmol (osm) de un compuesto es igual a la masa del mol dividida por el número de iones en que se separa cuando está en solución.
Para los compuestos que no se ionizan, el número de moles equivale al número de osmoles. Para los compuestos que se ionizan, en cambio, el número de osmoles será igual al número de moles multiplicado por el número de partículas liberadas en la ionización. Por ejemplo:
|
| Cuadro 2.9-Concentración en soluciones moleculares y soluciones iónicas |
Disociación del agua y Potencial de Hidrógeno (pH)
La disociación o ionización del agua es una reacción reversible en la cual una molécula de agua se separa en dos iones: un grupo hidroxilo y un protón. En la disociación del agua, la unión covalente polar entre el átomo de oxígeno y uno de los hidrógenos se rompe. Los dos electrones antes compartidos son retenidos por el oxígeno. Así, el grupo atómico formado por el oxígeno y el otro hidrógeno (que permanecen unidos covalentemente), adquiere un electrón extra, convirtiéndose en un anión con una carga negativa; ese anión es el grupo hidroxilo.
Por otro lado, queda un átomo de hidrógeno desprovisto de su electrón, lo que equivale a decir un núcleo de hidrógeno, o simplemente, un protón.
|
Fig. 2.23- Disociación del agua |
El agua tiene una baja tendencia a ionizarse. Como al ionizarse una molécula de agua se obtienen un OH- y un H+, la concentración de ambos iones en el agua pura es la misma y es igual a 10-7 moles / l.
[ ] = concentración
En el agua pura: [OH-] = [H+] = 10-7 mol/l
En química se utiliza la magnitud Potencial de hidrógeno o pH para indicar la concentración de protones [H+] o grado de acidez de un medio. El pH se define como el logaritmo negativo de la concentración de protones.
Potencial de hidrógeno = pH = - log [H+]
Para el agua pura →pH = 7
La escala de pH va de 1 a 14. El valor 7 corresponde a un medio neutro; un valor inferior a 7, a un medio ácido y un valor por encima de 7 a un medio básico o alcalino.
Al elegir el pH como expresión de la concentración de protones o acidez de un medio, cuanto mayores son estas, menor resulta el valor de pH. Por ejemplo, comparemos los medios A y B.
Para A -> [H+] = 0,001 mol/l = 10-3 mol/l ->pH = 3
Para B -> [H+] = 0,0001 mol/l = 10-4 mol/l -> pH = 4
El medio A es más ácido y tiene una concentración de protones 10 veces mayor que la del medio B.
Ácidos y Bases
Un ácido es una sustancia que, en solución acuosa, tiende a disociarse liberando un protón.
Una base o álcali es una sustancia que, en solución acuosa, capta protones del medio.
Los ácidos y las bases se catalogan como fuertes o débiles según su mayor o menor tendencia a ceder o captar protones, respectivamente.
|
Fig. 2.25- Ácidos y bases |
Lo que resta de la molécula de ácido, después de la cesión del protón, es su base conjugada. Si el ácido es fuerte, su base conjugada es débil y viceversa.
De la misma manera, el catión que se forma cuando una base ha captado un protón del medio, es el ácido conjugado de aquélla. Si la base es fuerte, su ácido conjugado es débil, y viceversa.
Hemos mencionado que, en el agua pura, la concentración de protones es igual a la de hidroxilos. Cuando al agua se le agrega un ácido, la concentración de protones supera a la de hidroxilos, porque a los liberados por el agua disociada se les suman los protones liberados por el ácido.
De modo inverso, cuando al agua se le agrega una base, esta capta protones libres. Por lo tanto, la concentración de hidroxilos supera a la de protones. Entonces:
Medio neutro-> [H+] = [OH-]
Medio ácido -> [H+] > [OH-]
Medio básico->[H+] < [OH-]
Buffers o amortiguadores del pH
Los valores de pH en diferentes compartimentos del organismo deben ser mantenidos dentro de rangos muy estrechos, para que el metabolismo se lleve a cabo adecuadamente. Pequeñas desviaciones en el pH sanguíneo causan la muerte. Para compensar esas desviaciones del pH, tanto en la sangre como en la célula existen los buffers o amortiguadores. Un buffer es un moderador del pH que está compuesto por un par conjugado ácido/base. Al contener el ácido y la base, el buffer puede ceder o captar protones según las circunstancias, retornando el pH a sus valores normales.
Compuestos orgánicos: generalidades
El átomo y los compuestos de Carbono
Los compuestos orgánicos son derivados del elemento carbono. Con número atómico 6, el átomo de carbono presenta 2 electrones en el nivel 1 y 4 electrones en el nivel 2, que es su nivel más externo. Por lo tanto, el carbono se estabiliza estableciendo 4 uniones covalentes. Las 4 valencias o posibilidades de unión del carbono se orientan en el espacio hacia los vértices de un imaginario tetraedro regular, cuyo centro está ocupado por el núcleo del átomo. No obstante esta orientación en el espacio, las uniones del carbono se representan gráficamente como si se hallaran sobre un mismo plano.
|
Fig. 2.26- El átomo de Carbono |
Los átomos de carbono tienen la particularidad de unirse entre sí, mediante uniones covalentes, que pueden ser ligaduras simples, dobles o triples, según los pares de electrones que comparten.
|
Fig. 2.27- Enlaces entre carbonos |
Al unirse entre ellos, los átomos de carbono forman cadenas lineales, cadenas ramificadas y ciclos.
|
Fig. 2.28- Cadenas y ciclos |
Según su posición en una cadena, un átomo de carbono puede estar unido a un solo átomo de carbono, a otros dos, a tres, o a cuatro átomos de carbono. Estas diferencias permiten clasificarlos en carbonos primarios, secundarios, terciarios y cuaternarios.
|
Fig. 2.29- Carbonos primarios, secundarios, terciarios y cuaternarios |
Los compuestos orgánicos más simples son los hidrocarburos, en los cuales las valencias del carbono se completan con átomos de hidrógeno. Por ejemplo
|
Fig. 2.30- Fórmulas de los hidrocarburos |
Cuando todos los enlaces entre carbonos son simples, el compuesto está saturado de hidrógeno. Si existen dobles o triples enlaces entre carbonos, la cantidad de hidrógeno es comparativamente menor y el compuesto es insaturado.
|
Fig. 2.31- Compuestos saturados (enlace simple) e insaturados (enlaces dobles o triples) |
Grupo funcional y función química
La enorme variedad de compuestos orgánicos deriva de los hidrocarburos, mediante sustitución de uno o más hidrógenos por otros átomos o grupos atómicos (por eso a los átomos o grupos atómicos distintos del hidrógeno que están unidos a un carbono se los suele llamar “sustituyentes”).
Se denomina grupo funcional a los átomos o grupos atómicos que, unidos a los carbonos de los compuestos orgánicos, son determinantes de las propiedades físico-químicas de los compuestos que los portan (Cuadro 2.10).
Una familia de compuestos con el mismo grupo funcional y, por lo tanto, con similares propiedades, recibe el nombre de función química. A los compuestos que pertenecen a la misma función química se los suele nombrar agregando a la raíz de su nombre un sufijo que los identifica como tales.
Radicales
Muchas veces en química orgánica se hace referencia a los radicales (R). Se entiende por radical a un grupo atómico que tiene un electrón sin compartir (una valencia libre). Los radicales llevan el nombre del compuesto o la función de la cual derivan, cambiando la terminación por el sufijo “ilo”. Por ejemplo, el radical derivado del metano es el “metilo” o el derivado de un ácido orgánico, un “acilo”.
|
Fig. 2.32- Compuesto y radical |
Isómeros
En química orgánica es muy común el fenómeno de isomería: la existencia de dos o más sustancias con la misma fórmula molecular, pero con diferentes propiedades. Estas sustancias son isómeros (iso: igual, mero: parte). Las moléculas de los isómeros están formadas por los mismos átomos, aunque distribuidos de distinta forma en el espacio.
Carbono quiral o asimétrico e isómeros ópticos
Se denomina C quiral o asimétrico a aquel que se halla unido a cuatro átomos o grupos atómicos diferentes. Por cada átomo de C asimétrico presente en un compuesto existen dos formas isoméricas llamadas isómeros ópticos o enantiómeros. Estos son como un objeto y su imagen especular, o como la mano derecha y la izquierda.
Cuando se hace pasar luz polarizada a través de soluciones acuosas de dos isómeros ópticos, se verifica que ambas desvían la luz en un ángulo de igual apertura, pero mientras que una solución la desvía hacia la derecha, la otra lo hace hacia la izquierda. A estos isómeros se los denomina dextrógiro y levógiro, respectivamente.
|
Fig. 2.33- Isómeros ópticos o enantiómeros |
Monómero y polímero Muchas de las moléculas orgánicas de importancia biológica tienen estructura de polímero. Un polímero (poli: mucho, mero: parte) es una molécula formada por un número grande de una o más moléculas “unidad”, a las que se llama monómeros (mono: uno). Existen homopolímeros (homo: igual) formados por la unión química de monómeros idénticos y heteropolímeros (hetero: distinto) que se obtienen por la unión de monómeros diferentes.
|
Fig. 2.34-Tipos de polímero |
Glúcidos o Hidratos de Carbono
Definición y origen
Los glúcidos, también llamados carbohidratos o hidratos de carbono, son compuestos orgánicos constituidos por carbono (C), hidrógeno (H) y oxígeno (O). Pueden definirse como polihidroxialdehídos o polihidroxicetonas y sus derivados. Los más simples son dulces y solubles en agua. Los de alto PM forman dispersiones coloidales o bien no se dispersan, aunque todos ellos son muy hidrofílicos.
Las plantas elaboran y almacenan glúcidos como su principal fuente de energía. En los cloroplastos de las hojas, en presencia de clorofila, absorben luz solar y unen el dióxido de carbono del aire y el agua del suelo para formar glucosa, un glúcido esencial. De este proceso, la fotosíntesis, se libera oxígeno (O2) a la atmósfera, como producto secundario.
El carbohidrato sintetizado en la fotosíntesis se utiliza para formar glúcidos más complejos y otros compuestos orgánicos. Cuando los animales los consumen, estos compuestos son la base de la vida animal. En consecuencia, se podría decir que el sol proporciona la energía para toda la materia viviente.
En las mitocondrias, los vegetales y los animales recuperan la energía encerrada en dichos compuestos, metabolizándolos con la adición de oxígeno, durante la respiración celular. Así forman los subproductos agua y dióxido de carbono, necesarios para que las plantas inicien nuevamente el ciclo.
|
Flujo de energía y materia |
Clasificación
Los glúcidos se clasifican en monosacáridos, oligosacáridos y polisacáridos. Los primeros son los más simples. Los oligosacáridos y los polisacáridos derivan de los glúcidos simples.
Monosacáridos
Los monosacáridos (mono: uno, unidad; sacárido: azúcar) son sustancias de sabor dulce, solubles en agua, formadas por cadenas de 3 a 7 átomos de carbono. Responden a la fórmula general Cn (H2O)n, es decir que por cada átomo de carbono tienen dos de hidrógeno y uno de oxígeno, lo que les valió el nombre de “hidratos de carbono”.
El grupo funcional principal es el carbonilo, ya sea aldehído o cetona, en los carbonos 1 ó 2, respectivamente. Al resto de los carbonos que forman la cadena se une un grupo hidroxilo.
Los monosacáridos, entonces, se clasifican del siguiente modo:
|
Cuadro 2.11-Clasificación de los monosacáridos |
Los monosacáridos poseen átomos de C quirales, y por lo tanto, isómeros ópticos. La posición del hidroxilo en el penúltimo C de la cadena (el último C quiral) permite diferenciar dos series: D y L. La serie D lleva el grupo hidroxilo hacia la derecha y la serie L hacia la izquierda. Los seres vivos sintetizan y metabolizan los monosacáridos de la serie D.
Las hexosas son los monosacáridos más abundantes en la naturaleza, entre ellos la glucosa (una aldohexosa), el azúcar que circula en sangre y combustible celular por excelencia y la fructosa (una cetohexosa), azúcar presente en los frutos y la miel.
|
Fig. 2.35- Fórmulas de cadena abierta de glucosa y fructosa |
Las pentosas y las hexosas pueden existir en dos formas estructurales: como cadenas lineales o como ciclos. Las formas cíclicas son las más frecuentes en solución acuosa. Además, cada forma cíclica tiene dos isómeros: α y β.
En el siguiente esquema se representa el proceso de ciclización de la glucosa. Los ángulos de unión entre los carbonos hacen que los extremos de la cadena se acerquen (se debe recordar que el átomo de C tiene estructura tetraédrica y sus uniones no se establecen en un solo plano, como se representa en el papel). El grupo aldehído del primer carbono reacciona con el grupo hidroxilo del quinto carbono. Así se forma un anillo hexagonal, uno de cuyos vértices es un átomo de oxígeno. Al formarse el ciclo, el grupo aldehído del primer carbono desaparece y su lugar es ocupado por un hidroxilo. Este nuevo hidroxilo en el primer carbono puede adoptar dos posiciones: por debajo o por encima del plano del anillo. Dicha alternativa es la que da lugar a la formación de los dos isómeros cíclicos: α y β respectivamente.
La representación de las estructuras cíclicas se realiza mediante las fórmulas de Haworth. Al pasar de la fórmula de estructura abierta a la de Haworth, los sustituyentes ubicados hacia la izquierda en la fórmula lineal se colocan por encima del anillo y los que estaban a la derecha, por debajo de aquel.
|
Fig. 2.36- Fórmulas de Haworth: alfa y beta glucosa |
Funciones de los monosacáridos
| Cuadro 2.12-Funciones de los monosacáridos |
|
Unión glicosídica
Los monosacáridos cíclicos, en particular las hexosas, se unen entre sí dando lugar a la formación de glúcidos más complejos. Genéricamente, esta unión recibe el nombre de unión glicosídica. Al formarse la unión, las hexosas quedan ligadas a través de un átomo de oxígeno, mientras que un protón y un hidroxilo se desprenden, formando una molécula de agua.
Toda unión química que se forma con desprendimiento de una molécula de agua es una condensación. La reacción inversa de la condensación es una hidrólisis (hidro: agua, lisis: ruptura). Significa que, adicionando agua, que aporta un protón y un hidroxilo, se rompe la unión, volviéndose a obtener las moléculas originales.
En la figura se ilustra la formación de una unión glicosídica entre dos moléculas de α-glucosa, en la cual intervienen el hidroxilo en posición 1 y el hidroxilo en posición 4 de las moléculas de glucosa reactivas. Por esto la unión se simboliza como α (1→4). El producto obtenido es el azúcar maltosa.
Las uniones glicosídicas dan origen a una gran variedad de compuestos, en función de distintos factores: cuáles son los monosacáridos que reaccionan, si participan con sus formas α o β, en qué posición se ubican los hidroxilos que reaccionan y finalmente, cuántas unidades de monosacáridos se integran a la cadena mediante estas uniones.
|
Fig. 2.37- Formación de maltosa |
Oligosacáridos
Los oligosacáridos (oligo: poco; sacárido: azúcar) se obtienen de la unión glicosídica de entre 2 y 10 monosacáridos. Los disacáridos y los trisacáridos son azúcares, pues conservan el sabor dulce.
Los oligosacáridos más representados en la naturaleza son los disacáridos. Entre ellos, la maltosa o azúcar de malta, ya mencionada; la sacarosa o azúcar de caña, transportada por las plantas a través de sus tallos y utilizada en la alimentación humana; y la lactosa o azúcar de leche. En los tres la glucosa es, cuando menos, uno de sus componentes:
Maltosa = α glucosa + α glucosa
Sacarosa = α glucosa + β fructosa
Lactosa = α glucosa + β galactosa (una aldohexosa)
Otros oligosacáridos de mucha significación para los seres vivos son los oligosacáridos de membrana, compuestos ramificados, presentes en las membranas celulares, donde forman parte de estructuras receptoras.
Polisacáridos
Los polosacáridos son polímeros, pues constan de numerosas unidades de monosacáridos unidas por enlaces glicosídicos.Los polisacáridos pueden ser homopolisacáridos, cuando están formados por una sola clase de monómero, o bien heteropolisacáridos, originados por la repetición de dos monómeros distintos, que se alternan en la cadena del polímero.
En cuanto a los homopolisacáridos, los más abundantes son polímeros de glucosa (glucanos o glucosanos); también hay polímeros de fructosa (fructosanos) o de manosa, otra aldohexosa (mananos).
El almidón, el glucógeno y la celulosa son glucanos de gran importancia biológica. Los dos primeros están constituidos por unidades de α glucosa y el tercero, por unidades de β glucosa.
El almidón es en realidad una mezcla de dos polímeros en proporciones variables, la amilosa y la amilopectina. La amilosa es una cadena lineal que adopta una disposición helicoidal. La amilopectina, en cambio, es ramificada, ya que presenta cadenas secundarias unidas a la cadena principal.
Si bien es prácticamente insoluble en agua fría, el almidón se dispersa cuando se lo calienta; entonces atrae gran cantidad de agua y forma un gel estable.
El almidón es sintetizado por las plantas como su principal reserva energética y se deposita en forma de gránulos, en tubérculos, raíces reservantes, granos de cereal y semillas, como las leguminosas. El tamaño de los gránulos y el peso molecular del almidón son muy variables, pues dependen de la actividad metabólica y las necesidades de la planta. Cuando la actividad fotosintética es intensa, se añaden unidades de glucosa, mientras que, por el contrario, el almidón se hidroliza si la planta requiere sus reservas para la obtención de energía.
El glucógeno, llamado almidón animal, posee una estructura similar a la de la amilopectina, aunque sus cadenas son más cortas y ramificadas. Es un polisacárido de reserva y se encuentra principalmente en el hígado y el músculo, a concentraciones del 10 y 2%, respectivamente. Si la concentración de glucosa en sangre disminuye, el glucógeno hepático es hidrolizado para aportar glucosa a la sangre y así suministrar este combustible a las células. La reserva de glucógeno muscular, en cambio, es consumida por este tejido durante la actividad física.
La celulosa es un polisacárido estructural. Es un material fibroso insoluble, cuyas cadenas muy largas y lineales, se unen entre sí mediante puentes de hidrógeno, constituyendo fibrillas. Dichas fibrillas son el material de sostén en las paredes celulares que rodean a las células vegetales.
|
Fig. 2.38- Polisacáridos: almidón, glucógeno y celulosa |
La quitina es un homopolisacárido constituido por unidades de un derivado de la glucosa, la N-acetil glucosamina. Sus cadenas lineales desempeñan un papel como material estructural de las paredes celulares de los hongos y el exoesqueleto de los artrópodos.
|
Fig. 2.39- Estructura de la quitina |
Los heteropolisacáridos son muy importantes por su función estructural en la matriz extracelular de los tejidos conectivos, donde se depositan formando una matriz en forma de gel hidratado. Se caracterizan porque uno de los monómeros suele ser un derivado de monosacáridos, por ejemplo azúcares con grupo amino, sulfato o ácido.
Papel alimentario del almidón y la celulosa
|
Para el hombre, además de los azúcares, el almidón y la celulosa son los hidratos de carbono de mayor presencia en la alimentación. El almidón se digiere en el tubo digestivo, hidrolizándose por completo a glucosa, la cual se incorpora al torrente sanguíneo. Aunque la celulosa consiste también en unidades de glucosa, no puede ser hidrolizada a su monómero absorbible en el intestino del hombre. Existen enzimas digestivas que hidrolizan las uniones entre moléculas de glucosa en el almidón, pero las uniones entre moléculas de glucosa de la celulosa no se ven afectadas por ninguna de las enzimas digestivas del hombre. Por ello, todas las moléculas de glucosa que contiene no están disponibles para la producción de energía. Sin embargo, a medida que las moléculas de celulosa avanzan por el tubo digestivo para ser eliminadas, cumplen una función útil: forman volumen, lo que favorece la evacuación intestinal. La celulosa es el principal componente de la llamada “fibra alimentaria”.
Los animales herbívoros, en cambio, pueden aprovechar la energía que encierra la celulosa, gracias a que poseen en su tubo digestivo una flora microbiana con las enzimas necesarias para hidrolizarla.
|
En el siguiente cuadro se resume la clasificación de los glúcidos.
|
Cuadro 2. 13- Clasificación de los glúcidos |
Lípidos
Definición
Los lípidos son un grupo heterogéneo de sustancias, cuyo carácter común es su insolubilidad en agua y su solubilidad en compuestos orgánicos como éter, benceno y cloroformo.
Ácidos grasos
Son los lípidos más simples. Aunque se los halla en pequeña cantidad en estado libre en los organismos, su importancia radica en que forman parte de las moléculas de la mayoría de los lípidos.
Los ácidos grasos (AG) son ácidos orgánicos, monocarboxílicos, que, salvo contadas excepciones, presentan una cadena hidrocarbonada lineal y número par de átomos de carbono.
La cadena de los ácidos grasos puede ser saturada (sin dobles ligaduras) o insaturada (con una o más dobles ligaduras).
Los ácidos grasos más abundantes en los animales son los de 16 y 18 átomos de carbono, considerados de cadena larga. Por ejemplo: el ácido esteárico, un ácido graso saturado (AGS) de 18 C y el oleico, un ácido graso también de 18 C, monoinsaturado (AGM).
Los átomos de C de un AG se enumeran a partir del grupo carboxilo, que es el grupo funcional principal. Los C adyacentes al carboxilo se denominan alfa (α) y beta (β) y el grupo metilo terminal corresponde al C omega (ω) o n.
Series omega: ω-3,ω-6, ω-9
Los ácidos grasos insaturados (AGI) se clasifican en tres series: ω-3, ω-6, ω-9. Esta clasificación se establece según la posición del primer doble enlace, contando desde el C omega. Los humanos podemos sintetizar AGS a partir de otros compuestos y AG omega-9 a partir de AG saturados. En cambio, solo podemos sintetizar las series omega-6 y omega-3 a partir de los ácidos linoleico y linolénico, respectivamente. Por este motivo, los ácidos linoleico y linolénico son considerados AG esenciales, que deben estar presentes en la dieta.
Los AG son moléculas anfipáticas, pues poseen un grupo polar, el carboxilo, la “cabeza” de la molécula, y una larga “cola” apolar, la cadena hidrocarbonada.
|
Fig. 2.41- Estructura de un AG |
El grupo carboxilo es un ácido débil, con baja tendencia a la disociación. En medio acuoso, los aniones carboxilato pueden formar emulsiones (dispersiones de líquido en líquido), agrupándose en pequeñas gotas llamadas micelas. Por su carácter anfipático, en cada micela los aniones de AG se ubican orientando sus colas hidrofóbicas hacia el interior de la micela, mientras que las cabezas polares se ponen en contacto con el agua circundante. Estas emulsiones son más estables si el AG forma un compuesto iónico o una sal con un metal, por ejemplo el Na+. Las sales de AG se denominan jabones.
|
Fig. 2.42- Micelas de AG en agua |
|
Fig. 2.43- Ionización de un AG |
Los AG insaturados presentan isómeros geométricos, llamados cis y trans. Estos se diferencian en la posición de los restos de cadena a ambos lados de la doble ligadura, según se aprecia en el esquema. En los isómeros cis, ambas cadenas se ubican hacia el mismo lado, mientras que en los trans, las cadenas se orientan hacia lados opuestos. La mayoría de los AG naturales adopta la posición cis. Esto se traduce en un ángulo en la cadena del AG a la altura de cada doble enlace. Los AG saturados y los trans, en cambio, tienen cadenas rectas.
La geometría de la molécula influye en el punto de fusión del AG. Los saturados y los trans, con sus formas rectilíneas, pueden acercarse más entre sí, lo que aumenta las fuerzas de atracción entre ellos. Esto determina que tengan puntos de fusión elevados: son menos fluidos a temperatura ambiente. Los AG cis, en cambio, no pueden acercarse tanto unos a otros, pues los limita el ángulo de sus cadenas. Entonces las fuerzas de atracción son más débiles y sus puntos de fusión, menores. A temperatura ambiente son más fluidos.
|
| Fig. 2.44- AG: Isómeros cis y trans . Obsérvese la forma quebrada del A. oleico (cis), frente a las formas rectilíneas del A. elaídico (isómero trans) y el A. esteárico (saturado). |
Grasas trans
|
Las grasas trans, utilizadas en la industria alimentaria, se obtienen por hidrogenación de ácidos grasos insaturados con el fin de convertirlos a su forma saturada y de esa manera lograr productos de consistencia más sólida; tal es el caso de la producción de margarinas a partir de aceites vegetales
Durante el proceso de hidrogenación se obtienen además isómeros trans. Por ejemplo, a partir del ácido oleico se forman ácido esteárico. y ácido ácido elaídico. Los isómeros trans son perjudiciales para la salud, pues favorecen la formación de placas llamadas ateromas que obstruyen la luz de las arterias. Por este motivo, la industria alimentaria se ha visto obligada a disminuir y declarar el contenido de grasas trans de sus productos.
|
Triacilgliceroles (triglicéridos o grasas neutras)
Los ácidos grasos reaccionan con el glicerol, un triple alcohol, formando ésteres de glicerol o acilgliceroles. Cada molécula de glicerol puede reaccionar con una, dos, o tres moléculas de ácido graso, dando origen a un monoacilglicerol, un diacilglicerol o un triacilglicerol, respectivamente. La unión entre glicerol y ácido graso es una unión éster (nombre genérico de la unión entre alcohol y ácido) y se forma por condensación, es decir con liberación de una molécula de agua.
Entonces:
Glicerol + 1 AG → Monoacilglicerol + 1 H2O
Glicerol + 2 AG → Diacilglicerol + 2 H2O
Glicerol + 3 AG → Triacilglicerol + 3 H2O
Los triacilgliceroles son los más abundantes, y se los conoce como triglicéridos o grasas neutras.
A continuación se esquematiza la formación de un triglicérido.
|
Fig. 2.45- Formación de un triglicérido |
Los triglicéridos reciben el nombre de grasas neutras, pues son compuestos completamente no polares, lo que les impide mezclarse con el agua, es decir, son hidrofóbicos. Debe tenerse en cuenta que si bien, por separado, el glicerol es polar (debido a sus grupos hidroxilo) y los ácidos grasos son anfipáticos, las partes polares de estas moléculas participan del enlace éster y quedan completamente enmascaradas en el interior del triglicérido cuando están unidas.
Los triglicéridos generalmente son mixtos, esto es: están formados por mezclas de ácidos grasos distintos. Los triglicéridos en los que predominan los ácidos grasos saturados son sólidos o pastosos a temperatura ambiente y se denominan grasas. Cuando predominan los ácidos grasos insaturados, los triglicéridos son líquidos a temperatura ambiente y reciben el nombre de aceites.
Algunas plantas reservan aceites en sus frutos o semillas. Las grasas, en cambio, son productos típicamente animales. Los animales utilizan las grasas como su principal depósito de energía a largo plazo. Depósito que, por otra parte, es ilimitado.
¿Por qué el principal depósito de energía en los animales es la grasa y no el glucógeno (almidón animal)? En primer lugar, cuando se oxidan, las grasas proporcionan 9 Kcal/g, frente a las 4 Kcal/g que rinden los glúcidos. La densidad energética de las grasas es mucho mayor que la de los glúcidos.
En segundo lugar, los glúcidos son muy hidrofílicos. Esto significa que en un depósito de almidón o glucógeno hay un peso extra debido al agua atraída por estos compuestos hidrofílicos; ese peso extra no rinde energía. Para las plantas, un depósito pesado no es problema porque no se trasladan. Pero para un animal que se desplaza, un depósito muy grande de glúcidos sería un lastre imposible de acarrear.
Fosfolípidos y Glucolípidos
Los fosfolípidos pueden derivar del glicerol o de otro alcohol llamado esfingol. Los glicerofosfolípidos son ésteres de glicerol con dos ácidos grasos y un ácido fosfórico. El compuesto así formado se denomina ácido fosfatídico. Los glicerofosfolípidos contienen además una base nitrogenada variable, unida al ácido fosfórico.
Los esfingofosfolípidos derivan de la ceramida, compuesto fornado por esfingol unido a un ácido graso. El esfingol también se combina con ácido fosfórico y este con una base nitrogenada variable.
Los glucolípidos se forman a partir de la ceramida combinada con un glúcido, ya sea glucosa, galactosa o bien un oligosacárido.
|
Fig. 2.46- Fosfolípidos y glucolípidos |
Tanto los fosfolípidos como los glucolípidos son moléculas anfipáticas. Ambos presentan una “cabeza” que corresponde a sus grupos polares y es hidrofílica, y dos “colas” hidrofóbicas, correspondientes a sus partes no polares. Al igual que los ácidos grasos, pueden formar micelas. Sin embargo, su propiedad más importante es la posibilidad de formar bicapas, que se cierran sobre sí mismas, cuando se encuentran en un medio acuoso.
En una bicapa, estos lípidos se ubican con sus cabezas orientadas hacia el agua y sus colas enfrentadas, de modo que escapan del agua. Además, las bicapas se cierran, para no exponer al agua sus superficies laterales hidrofóbicas. Así forman pequeños sacos o vesículas.
|
| Fig. 2.47- Fosfolípidos y glucolípidos: formación de bicapas y vesículas en medio acuoso. |
Debido a su comportamiento frente al agua, los fosfolípidos y los glucolípidos son los compuestos ideales para formar el límite de la célula, una estructura rodeada de agua y con un contenido acuoso. En efecto, las membranas celulares son, básicamente, bicapas lipídicas.
A pesar de su contenido en ácidos grasos, los fosfolípidos y glucolípidos no cumplen una función energética, sino estructural.
Esteroides
|
Fig. 2.48- Estructura del colesterol |
Son un grupo de lípidos asociados derivados del ciclopentanoperhidrofenantreno. En este grupo se muchos compuestos de importancia fisiológica, entre ellos el colesterol.
El colesterol presenta un grupo hidroxilo unido a la estructura cíclica y. aunque predomina su parte apolar, puede considerárselo anfipático. Como tal, es un componente importante de las membranas celulares animales (no de las vegetales), especialmente abundante en determinados órganos, como cerebro, hígado y riñón.
Además, el colesterol es precursor o materia prima de muchas otras sustancias de importancia fisiológica: las hormonas esteroides, la vitamina D y las sales biliares.
| Cuadro 2.14- Resumen de los principales grupos de lípidos |
|
Lipoproteínas
Las lipoproteínas son complejos que permiten el transporte de lípidos hidrofóbicos en el plasma. Los triglicéridos o ésteres de colesterol, totalmente apolares, se ubican en el centro, mientras que las proteínas y los lípidos anfipáticos, como fosfolípidos y colesterol libre, se ubican en la periferia de las lipoproteínas, formando una monocapa. Las proteínas de la superficie caracterizan a cada tipo de lipoproteína e interaccionan específicamente con receptores localizados en las membranas celulares. Algunas proteínas tienen función enzimática e intervienen en el metabolismo de los lípidos.
Las lipoproteínas pueden ser separadas por la técnica de electroforesis o bien mediante ultracentrifugación. Este último método permite la separación según la densidad. Cuanto mayor es el contenido de lípidos de una lipoproteína, menor es su densidad.
En virtud de este criterio, se reconocen varios grupos de lipoproteínas.
De menor a mayor densidad:
- Quilomicrones (QM)
- Lipoproteínas de muy baja densidad (VLDL, por “very low density lipoprotein”)
- Lipoproteínas de densidad intermedia (IDL, por “intermediate density lipoprotein”)
- Lipoproteínas de baja densidad (LDL, por “low density lipoprotein”)
- Lipoproteínas de alta densidad (HDL, por “high density lipoprotein”).
|
Fig. 2.49- Estructura y composición de las lipoproteínas plasmáticas |
Proteínas
Definición
Son polímeros lineales de L-aminoácidos unidos mediante enlace peptídico. Las proteínas son macromoléculas muy versátiles, que desempeñan tanto funciones estructurales como dinámicas.
Aminoácidos
Los aminoácidos son las moléculas unitarias, los monómeros de las proteínas. Todos los aminoácidos tienen una estructura común, que consiste en un átomo de carbono, el carbono α unido a un grupo carboxilo, un grupo amino y un átomo de Hidrógeno. La cuarta valencia del carbono α se completa con un grupo atómico de estructura variable, al que identificaremos como R (por Radical).
|
Fig. 2.50- Estructura de un aminoácido |
En el aminoácido de estructura más sencilla, la glicina, el R es un átomo de Hidrógeno.
Exceptuando la glicina, en todos los demás aminoácidos el carbono α es un carbono asimétrico o quiral. Así se denomina a los átomos de carbono unidos a cuatro grupos atómicos diferentes.
Las moléculas que, como los aminoácidos, tienen carbonos asimétricos, presentan isomería óptica. Es decir, por cada carbono asimétrico existen dos formas isoméricas, llamadas isómeros ópticos, que son imágenes especulares una de la otra. Los isómeros ópticos pertenecen a las series D o L. Los aminoácidos utilizados por los seres vivos son siempre de la serie L. Estos se representan con el grupo amino ubicado a la izquierda.
Por lo general, los aminoácidos adquieren carga eléctrica en solución acuosa, ya que tanto el grupo amino como el carboxilo son ionizables.
|
Fig. 2.51- Aminoácidos D y L |
El grupo amino es básico y adquiere carga positiva cuando capta un protón. El grupo carboxilo, en tanto ácido, puede ceder un protón y adquirir carga negativa. Según la concentración de protones libres disponibles en el medio donde se encuentre (según el pH), el aminoácido será un catión, un anión, o un ión dipolar, si ambos grupos se ionizan simultáneamente.
Se dice que los aminoácidos son anfolitos o anfóteros, pues tienen la capacidad de comportarse como bases o como ácidos; esta capacidad los faculta para actuar como amortiguadores del pH.
|
Fig. 2.52- Comportamiento de un aminoácido según la acidez del medio |
El grupo R o Radical de los aminoácidos es diferente para cada uno de ellos. Existen 20 radicales diferentes; por lo tanto, 20 clases de aminoácidos distintos forman las proteínas.
Si bien los 20 aminoácidos son necesarios, hay 8 de ellos que la especie humana no puede sintetizar y debe adquirir con la alimentación; son los llamados aminoácidos esenciales.
Según la composición de sus radicales, los aminoácidos se clasifican en apolares, polares con densidad de carga y polares con tendencia a ionizarse, es decir, con tendencia a adquirir carga neta. Entre los últimos están los aminoácidos básicos y los ácidos, que son los que llevan otro grupo amino o carboxilo, respectivamente, en su radical.
Enlace peptídico
El enlace peptídico se produce al reaccionar el grupo amino de un aminoácido con el grupo carboxilo de otro aminoácido. Los aminoácidos así combinados se llaman restos o residuos de aminoácidos.
La formación del enlace peptídico ocurre por una reacción de condensación, con desprendimiento de una molécula de agua. La reacción inversa o ruptura del enlace peptídico requiere la adición de agua y se denomina hidrólisis. La hidrólisis de los enlaces peptídicos da como producto aminoácidos libres.
|
Fig. 2.54- Formación del enlace peptídico |
Péptidos
Una cadena que contiene dos o más residuos de aminoácidos es un péptido. Si la cadena consta de dos a diez residuos se la llama oligopéptido y cuando contiene por encima de diez residuos, polipéptido. Una proteína es un polipéptido de alto peso molecular, pero el límite entre ambos es arbitrario y varía según los autores.
|
Fig. 2.55- Cadena peptídica |
Los péptidos presentan dos extremos distintos: el N-terminal y el C-terminal. El N-terminal es el que tiene un residuo de aminoácido con grupo amino libre; este residuo es considerado el primero de la cadena. El extremo C-terminal es el que tiene un residuo de aminoácido con el grupo carboxilo libre; este es considerado el último residuo de la cadena.
Niveles estructurales de las proteínas
Todas las proteínas son cadenas de alto peso molecular formadas por residuos de aminoácidos. ¿En qué se diferencia una proteína de otra? Las proteínas se diferencian, en primer lugar, por el número, tipo y orden de los aminoácidos que constituyen su cadena. La secuencia de aminoácidos que presenta una proteína particular se denomina estructura primaria. La estructura primaria está sostenida por los enlaces peptídicos que mantienen a los aminoácidos unidos en cadena.
En algunas proteínas hay más de un residuo del aminoácido cisteína, que lleva un grupo sulfhidrilo en su radical. Dos residuos de cisteína pueden establecer una unión covalente entre los átomos de azufre, el puente disulfuro. La posición de los puentes disulfuro, cuando están presentes, forma parte de la estructura primaria.
|
Fig. 2.56- Puente disulfuro |
Cada proteína no solo se caracteriza por su estructura primaria, o secuencia particular de aminoácidos, sino también por una estructura espacial determinada, llamada conformación nativa, que resulta del plegamiento en el espacio de la cadena polipeptídica. Cada proteína adopta siempre la misma conformación nativa, si las condiciones del medio lo permiten. Esto indica que la forma de una proteína depende de su estructura primaria.
El primer nivel de plegamiento de una cadena proteica se denomina estructura secundaria. La estructura secundaria puede ser regular, como la α hélice o la hoja plegada β, o no seguir un patrón regular, en cuyo caso recibe el nombre de plegamiento aleatorio.
Las estructuras secundarias se originan porque se establecen uniones puentes de hidrógeno entre los restos amino y carboxilo de aminoácidos que están relativamente distantes en la estructura primaria, produciendo así un acercamiento entre ellos.
La estructura terciaria es la disposición global que adoptan en el espacio las distintas regiones de una proteína, después de haber adquirido su estructura secundaria. Esta disposición depende de interacciones que se establecen entre radicales, en general bastante alejados en la estructura primaria. Entre dichas interacciones se cuentan: uniones iónicas, puentes de hidrógeno, interacciones hidrofóbicas (todas ellas uniones no covalentes) y puentes disulfuro.
Algunas proteínas tienen estructura cuaternaria. Esta estructura se alcanza cuando la proteína está formada por dos o más cadenas polipeptídicas unidas entre sí por uniones no covalentes entre los radicales. A cada una de las cadenas que constituyen la proteína se le da el nombre de protómero o subunidad. Las proteínas de estructura cuaternaria también se conocen como proteínas oligoméricas (Fig.2.57; Cuadro 2.15).
Cuadro 2.15-Niveles estructurales de las proteínas |
|
|
Fig. 2.57- Niveles estructurales de las proteínas |
Desnaturalización
La desnaturalización es la destrucción de la conformación nativa de una proteína, sin que se vea afectada su estructura primaria. La proteína conserva la cadena, es decir la secuencia de aminoácidos unidos por uniones peptídicas, pero no su estructura espacial. Cuando una proteína se desnaturaliza, la función biológica se pierde, ya que esta se halla estrechamente ligada a la forma.
Dado que la conformación nativa de una proteína está sostenida por uniones relativamente débiles, muchos agentes son capaces de afectarla, por ejemplo: calor, radiaciones, congelamientos repetidos, grandes presiones, ácidos o bases muy concentrados que provocan marcados cambios de pH, algunos solventes orgánicos, etc.
|
Fig. 2.58- Desnaturalización |
Funciones de las proteínas
Las proteínas desempeñan infinidad de funciones: hormonal, de sostén, contráctil, de transporte, de defensa, regulación genética, recepción de señales, enzimática y muchas otras. También pueden ser oxidadas para la producción de energía (rinden 4 Kcal/g) aunque no se reservan con este fin.
Todos hemos oído hablar de la información genética y se sabe que esta información, guardada en las moléculas de ADN, es la responsable de las características de un organismo y de las diferencias entre una planta y un perro, o entre dos personas. Lo que no todos saben es que la información que guarda el ADN es la información para fabricar proteínas. No heredamos el color de pelo, o la estatura, heredamos recetas con las instrucciones para elaborar determinadas proteínas. Luego, las proteínas son las encargadas de dotar al organismo de su estructura, su función y sus características propias.
Ácidos Nucleicos
Introducción
Todas las células contienen la información necesaria para realizar distintas reacciones químicas mediante las cuales las células crecen, obtienen energía y sintetizan sus componentes. Está información está almacenada en el material genético, el cual puede copiarse con exactitud para transmitir dicha información a las células hijas. Sin embargo estas instrucciones pueden ser modificadas levemente, es por eso que hay variaciones individuales y un individuo no es exactamente igual a otro de su misma especie (distinto color de ojos, piel, etc.). De este modo, podemos decir que el material genético es lo suficientemente maleable como para hacer posible la evolución.
La información genética o genoma, está contenida en unas moléculas llamadas ácidos nucleicos. Existen dos tipos de ácidos nucleicos: ADN y ARN. El ADN guarda la información genética en todos los organismos celulares, el ARN es necesario para que se exprese la información contenida en el ADN; en los virus podemos encontrar tanto ADN como ARN conteniendo la información (uno u otro nunca ambos).
Composición química y estructura de los ácidos nucleicos
Los ácidos nucleicos resultan de la polimerización de monómeros complejos denominados nucleótidos.
Un nucleótido está formado por la unión de un grupo fosfato al carbono 5’ de una pentosa. A su vez la pentosa lleva unida al carbono 1’ una base nitrogenada.
|
Fig. 2.59 - Estructura del nucleótido monofosfato de adenosina (AMP) |
Las bases nitrogenadas son moléculas cíclicas y en la composición de dichos anillos participa, además del carbono, el nitrógeno. Estos compuestos pueden estar formados por uno o dos anillos. Aquellas bases formadas por dos anillos se denominan bases púricas (derivadas de la purina). Dentro de este grupo encontramos: Adenina (A), y Guanina (G).
Si poseen un solo ciclo, se denominan bases pirimidínicas (derivadas de la pirimidina), como por ejemplo la Timina (T), Citosina (C), Uracilo (U).
Estos derivados de la purina y la pirimidina son las bases que se encuentran con mayor frecuencia en los ácidos nucleicos.
|
Fig. 2.60- Bases púricas y pirimídicas |
Existen otras bases nitrogenadas que son menos frecuentes, algunas de ellas están metiladas. En eucariontes estas bases metiladas participan del control de la expresión genética.
|
Fig. 2.61 - Bases menos frecuentes |
Nucleótidos de importancia biológica
ATP (adenosín trifosfato): Es el portador primario de energía de la célula. Esta molécula tiene un papel clave para el metabolismo de la energía. La mayoría de las reacciones metabólicas que requieren energía están acopladas a la hidrólisis de ATP.
Este nucleótido posee tres grupos fosfatos unidos entre sí. Estos grupos fosfatos a pH celular se encuentran desprotonados, de manera que poseen cargas negativas. Como estas cargas están muy cerca se repelen fuertemente. Para mantenerlos juntos, se establecen uniones de alta energía entre los fosfatos, por lo tanto, cuando la molécula se hidroliza la energía se libera. Del mismo modo para sintetizar una molécula de ATP se requiere energía.
|
Fig. 2.62 - ATP (Adenosín trifosfato) |
AMP cíclico: Es una de las moléculas encargadas de transmitir una señal química que llega a la superficie celular al interior de la célula, es un segundo mensajero).
|
Fig. 2.63 - Estructura del AMP C |
NAD+ y NADP+: (nicotinamida adenina dinucleótido y nicotinamida adenina dinucleótido fosfato). Son coenzimas que intervienen en las reacciones de oxido-reducción, son moléculas que transportan electrones y protones. Intervienen en procesos como la respiración y la fotosíntesis.
|
| Fig. 2.64 - Estructura del NAD+, La nicotinamida acepta hidrogeniones, proceso denominado reducción |
FAD+: También es un transportador de electrones y protones. Interviene en la respiración celular.
Coenzima A: Es una molécula que transporta grupos acetilos, interviene en la respiración celular, en la síntesis de ácidos grasos y otros procesos metabólicos.
Polinucleótidos
Existen dos clases de nucleótidos, los ribonucleótidos en cuya composición encontramos la pentosa ribosa y los desoxirribonucleótidos, en donde participa la desoxirribosa.
Los nucleótidos pueden unirse entre sí, mediante enlaces covalentes, para formar polímeros, es decir los ácidos nucleicos, el ADN y el ARN.
Dichas uniones covalentes se denominan uniones fosfodiéster. El grupo fosfato de un nucleótido unido por enlace éster al carbono 5`de la pentosa, se enlaza por unión puente fosfodiéster al hidroxilo en posición 3` de la pentosa correspondiente al siguiente nucleótido. De este modo cada cadena polinucleotídica presenta dos extremos en donde se exponen grupos químicos libres, por un lado el grupo fosfato en posición 5`del primer nucleótido y en el extremo opuesto, el grupo hidroxilo en posición 3`correspondiente al nucleótido terminal.
|
Fig. 2.65 - Estructura de un polirribonucleótido |
ADN – Ácido desoxirribonucleico
Los ácidos nucleicos fueron aislados por primera vez en 1869, sin embargo no fue hasta mucho después que se conoció su función. A principio de siglo los científicos que querían explicar cómo se transmitía y se almacenaba la información genética se enfrentaron a un problema, era el ADN o las proteínas de los cromosomas los que portaban la información genética.
Se sabía que el ADN constaba de solo cuatro tipo de monómeros, frente a los 20 aminoácidos que se encuentran formando parte de las proteínas, de manera que se pensaba que era demasiado sencillo como para guardar la información, por lo cual se le asignaba una función estructural.
La evidencia que ha servido para esclarecer la función del ADN, ha procedido, por un lado, del hecho que la cantidad de ADN de una especie es constante, sin importar la edad, sexo, factores nutricionales o ambientales.
Por otra parte, la cantidad de ADN tiene mayoritariamente una relación directa con la complejidad del organismo, así como también se observa que las gametas de los individuos con reproducción sexual poseen solo la mitad del ADN que posee cualquier de sus células somáticas.
Sin embargo esto por sí solo no confirmó la función del ADN. Por ello se llevaron a cabo una serie de experimentos que lo demostraron en forma concluyente.
En 1928, Griffith experimentó con distintas cepas de bacterias, una de ellas era la forma llamada lisa (L), rodeada de una cápsula de polisacáridos y causante de neumonía en los ratones. En contraste, la cepa rugosa, no contenía el polisacárido y no era virulenta.
Griffith experimentó con tres grupos de ratones. Al primero le inyectó la cepa lisa muertas por calor, mientras que al segundo grupo lo inoculó con la cepa rugosa viva y al tercero lo inoculado con una mezcla de cepa R viva con cepa L muertas por calor. En este último caso los ratones morían de neumonía, es decir que las células rugosas se habían transformado en cepas virulentas. En 1944 se demostró que ese principio transformador era el ADN y no las proteínas.
|
Fig. 2.66 - Experimento de Griffith |
Otra serie de experimentos realizados en 1952 por Hershey y Chase, demostraron en forma indiscutible que el ADN es el material genético. Trabajaron con virus llamados bacteriófagos. Los bacteriófagos están formados por ADN y proteínas, las proteínas forman una cubierta y en su interior se aloja el ADN. Se cultivaron virus en un medio que contenía fósforo radiactivo, de manera que al sintetizar su ADN, la molécula quedaba marcada radiactivamente. Otros virus se hicieron crecer en medio con azufre radiactivo, quedando marcadas radiactivamente las proteínas. Los virus tienen un mecanismo de acción muy particular, ya que no ingresan a la célula que infectan sino que solo inyectan su material genético. Luego se pusieron en contacto los virus que poseían las proteínas radiactivas con un cultivo de bacterias y lo mismo se hizo con los virus que tenían el ADN marcado.
Si la información genética estaba contenida en el ADN la marca radiactiva debía estar en el interior de las bacterias de este último grupo, por el contrario si eran las proteínas las que cumplían dicha función la marca radiactiva estaría adentro de las bacterias del primer grupo.
|
Fig. 2.67 - Experimento de Hershey y Chase |
El resultado del experimento confirmó que el ADN era la molécula que buscaban, ya que se encontraba la marca radioactiva en el interior de las bacterias que se pusieron en contacto con ADN marcado.
Una vez establecida su función faltaba determinar su estructura, como era posible que esa estructura repetitiva almacenara las distintas instrucciones.
En 1953, Watson y Crick propusieron el modelo de doble hélice, para esto se valieron de los patrones obtenidos por difracción de rayos X de fibras de ADN, y de los postulados enunciados por Chargaff que establecían que la cantidad de adenina de una molécula de ADN era igual a la cantidad de timina de la misma molécula y que la cantidad de guanina era igual a la cantidad de citosina, es decir que el contenido de purinas era igual al de pirimidinas.
El modelo de la doble hélice establece que las bases nitrogenadas de las cadenas se enfrentan y establecen entre ellas uniones del tipo puente de hidrógeno. Este enfrentamiento se realiza siempre entre una base púrica con una pirimidínica, lo que permite el mantenimiento de la distancia entre las dos hebras. La adenina se une con la timina formando dos puentes de hidrógeno y la citosina con la guanina a través de tres puentes de hidrógeno. Las hebras son antiparalelas, pues una de ellas tiene sentido 5’ ->3’, y la otra sentido 3’ ->5’.
El modelo de Watson y Crick, describe a la molécula del ADN como una doble hélice, enrollada sobre un eje, como si fuera una escalera de caracol y cada diez pares de nucleótidos alcanzan para dar un giro completo.
Excepto en algunos virus, el ADN siempre forma una cadena doble.
|
Fig. 2.68 - Pares de bases del ADN: La formación específica de enlaces de hidrógeno entre G y C y entre A y T genera los pares de bases complementarias |
Factores que estabilizan la doble hélice
Los puentes de hidrógeno entre las bases tienen un papel muy importante para estabilizar la doble hélice, si bien individualmente son débiles hay un número extremadamente grande a lo largo de la cadena.
Las interacciones hidrofóbicas entre las bases también contribuyen con la estructura.
Los grupos fosfatos que se encuentran en el exterior de la doble hélice pueden reaccionar con el agua aportando mayor estabilidad.
|
Fig. 2.69 - Una corta sección de la doble hélice de ADN |
Función biológica
El ADN es el portador de la información genética y a través de ella puede controlar, en forma indirecta, todas las funciones celulares.
Debemos recordar aquí que las enzimas son proteínas que catalizan todas las funciones biológicas y se sintetizan en las células de acuerdo a la información genética. Vale decir que a la información genética la podemos comparar con un recetario, donde están las recetas de todas las proteínas del organismo.
Encontramos ADN en el núcleo de las células animales y vegetales, en los organismos procariontes, en organoides como los cloroplastos y mitocondrias, como así también en algunos virus, a los que llamamos ADN - virus.
|
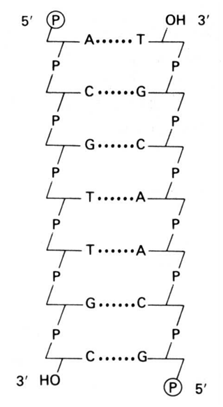 |
Fig. 2.70 – (a) Modelo de la doble hélice de ADN, (b) Representación abreviada de un segmento de ADN. |
ARN – Ácido ribonucleico
El ácido ribonucleico se forma por la polimerización de ribonucleótidos. Estos a su vez se forman por la unión de:
a) un grupo fosfato. b) ribosa, una aldopentosa cíclica y c) una base nitrogenada unida al carbono 1’ de la ribosa, que puede ser citosina, guanina, adenina y uracilo. Esta última es una base similar a la timina.
En general los ribonucleótidos se unen entre sí, formando una cadena simple, excepto en algunos virus, donde se encuentran formando cadenas dobles.
La cadena simple de ARN puede plegarse y presentar regiones con bases apareadas, de este modo se forman estructuras secundarias del ARN, que tienen muchas veces importancia funcional, como por ejemplo en los ARNt (ARN de transferencia).
Se conocen tres tipos principales de ARN y todos ellos participan de una u otra manera en la síntesis de las proteínas. Ellos son: El ARN mensajero (ARNm), el ARN ribosomal (ARNr) y el ARN de transferencia (ARNt).
|
Fig. 2.71 - Esquema de una ARNm bacteriano |
ARN mensajero (ARNm)
Consiste en una molécula lineal de nucleótidos (monocatenaria), cuya secuencia de bases es complementaria a una porción de la secuencia de bases del ADN. El ARNm dicta con exactitud el orden de la secuencia de aminoácidos en una cadena polipeptídica en particular. Las instrucciones residen en tripletes de bases a las que llamamos codones. Son los ARN más largos y pueden tener entre 1000 y 10000 nucleótidos
En los eucariontes los ARNm derivan de moléculas precursoras de mayor tamaño que se conocen en conjunto como ARN heterogéneo nuclear (hnARN), el cual presenta secuencias internas no presentes en ARN citoplasmáticos.
ARN ribosomal (ARNr)
Este tipo de ARN una vez transcripto, pasa al nucleolo donde se une a proteínas. De esta manera se forman las subunidades de los ribosomas. Aproximadamente dos terceras partes de los ribosomas corresponde a sus ARNr.
|
Fig. 2.72 - Diagrama de un ribosoma procarionte |
ARN de transferencia (ARNt)
Este es el más pequeño de todos, tiene aproximadamente 75 nucleótidos en su cadena, además se pliega adquiriendo lo que se conoce con forma de hoja de trébol plegada. El ARNt se encarga de transportar los aminoácidos libres del citoplasma al lugar de síntesis proteica. En su estructura presenta un triplete de bases complementario de un codón determinado, lo que permitirá al ARNt reconocerlo con exactitud y dejar el aminoácido en el sitio correcto. A este triplete lo llamamos anticodón.
|
Fig. 2.73- Molécula de ARNt |
ARN pequeño nuclear (ARNpn o snRNA)
En eucariontes encontramos un grupo de seis ARN que están en el núcleo, el ARN pequeño nuclear, estos desempeñan cierto papel en la maduración del ARNm.
Ribozimas
Son ARN que tienen función catalítica, participan activamente en la maduración de los ARNm.
Función de los ARN
Un gen está compuesto, como hemos visto, por una secuencia lineal de nucleótidos en el ADN, dicha secuencia determina el orden de los aminoácidos en las proteínas. Sin embargo, el ADN no proporciona directamente la información para el ordenamiento de los aminoácidos y su polimerización, sino que lo hace a través de otras moléculas, los ARN. Todo el proceso que se lleva a cabo para la síntesis de proteínas se verá detalladamente en otro capítulo.
|
