INTRODUCCIÓN AL METABOLISMO
Silvia Márquez – Sergio D. Ifrán – Nancy Fernández – Gladys Gálvez – Luis Fernández
La célula viva se asemeja a una industria química donde miles de reacciones ocurren dentro de un espacio, en este caso, un espacio microscópico. Por ejemplo, los azúcares son convertidos en aminoácidos y viceversa. El glucógeno es ensamblado a partir de miles de moléculas de glucosas; las proteínas a partir de aminoácidos. Por otro lado, estos polímeros serán hidrolizados cuando las necesidades de la células así lo requieran.
El metabolismo (del griego “metabole”, cambio) es la totalidad de los procesos químicos de un organismo. El metabolismo es “el mapa de rutas” de miles de reacciones químicas que ocurren en la célula. Las enzimas dirigen dichas rutas metabólicas, acelerando diferencialmente reacciones determinadas.
Como un todo, el metabolismo maneja las fuentes de materia y energía de la célula. Algunas rutas metabólicas liberan energía por ruptura de los enlaces químicas de moléculas complejas a compuestos más simple. Estos procesos de degradación constituyen el catabolismo celular o vías catabólicas. Por otro lado, existen vías anabólicas o reacciones químicas del anabolismo, las que consumen energía para construir moléculas de mayor tamaño a partir de moléculas más simples. Las vías metabólicos se interceptan de tal forma que la energía liberada de reacciones catabólicas (reacciones exergónicas) puede utilizarse para llevar a cabo reacciones anabólicas (reacciones endergónicas)
Así, la transferencia de energía del catabolismo al anabolismo se denomina acoplamiento energético.
Los organismos son transformadores de energía
La energía ha sido definida como la capacidad de realizar trabajo, de producir una modificación en la materia. Puede adoptar la forma de calor, luz, electricidad, movimiento, etc.
Se reconocen dos clases principales de energía:
l Energía potencial
l Energía cinética
La energía potencial es la capacidad de realizar trabajo en virtud de la posición o el estado de una partícula. Por ejemplo, una piedra en la cima de una montaña tiene energía potencial, a medida que rueda por su ladera, la energía potencial se transforma en cinética. La energía derivada en última instancia del sol, se almacena en las moléculas de los alimentos como energía química. Esta última es un tipo de energía potencial. Luego dentro del organismo, se producen reacciones químicas que transforman la energía potencial en calor, movimiento o alguna otra forma de energía cinética.
Todas las formas de energía son, por lo menos en parte, interconvertibles. Los sistemas vivientes constantemente transforman energía potencial en cinética o viceversa.
La energía química que los organismos utilizan en las reacciones metabólicas, proviene de los enlaces químicos de los glúcidos, lípidos y proteínas. Esta energía potencial que guardan los enlaces químicos, puede ser aprovechada parcialmente por el organismo cuando se rompen esos enlaces químicos. La energía que no puede ser atrapada por el organismo, se disipa como calor.
En condiciones experimentales controladas, puede medirse y compararse la cantidad de energía que entra y sale de un sistema determinado.
La termodinÁmica es el estudio de la energía
El análisis de las transformaciones energéticas que ocurren en la materia viva se llama termodinámica.
Los investigadores llaman sistema para denotar una porción de materia bajo estudio. El resto del universo (todo aquello fuera del sistema) es el entorno.
Los organismos son sistemas termodinámicos obligatoriamente abiertos, es decir intercambian materia y energía con el entorno.
La termodinámica tiene dos leyes fundamentales que gobiernan las transformaciones energéticas de la materia y por lo tanto también rigen para los seres vivos.
La Primera Ley de Termodinámica o de la Conservación de la Energía establece que la energía puede convertirse de una forma en otra, pero no se la puede crear ni destruir. La energía total de un sistema y su ambiente, por lo tanto se mantiene constante a pesar de todos los cambios de forma.
En todas las conversiones energéticas, cierta energía útil se convierte en calor y se disipa. De todos modos, en una reacción química, la energía de los productos de la reacción más la energía liberada en la misma, es igual a la energía inicial de las sustancias que reaccionan.
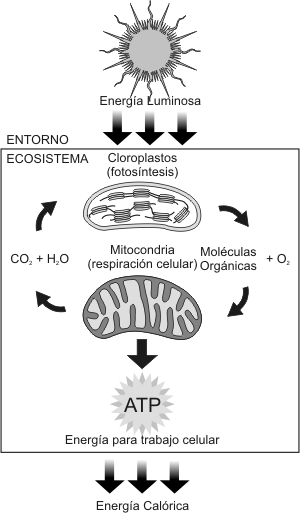
Fig. 3.1 - Flujo de energía y materia en un ecosistema. Las mitocondrias
de los eucariotas (¡incluso plantas!) utiliza las moléculas orgánicas
producto de la fotosíntesis como combustible para la respiración celular,
pero también consume el oxígeno liberado en la fotosíntesis. La respiración
libera la energía almacenada en las moléculas orgánicas y genera ATP,
el cual se utiliza para el trabajo celular. Los productos de desecho de
la respiración, CO2 y H2O, son las moléculas que
los cloroplastos utilizan como sustrato de la fotosíntesis. Por lo tanto,
las moléculas esenciales de la vida son recicladas, pero la energía no.
La energía ingresa al ecosistema como energía lumínica y sale como energía
calórica.
La Segunda Ley de la Termodinámica establece que todos los intercambios y conversiones de energía, si no entra ni sale energía del sistema en estudio, la energía potencial del estado final siempre será menor que la energía potencial del estado inicial. Por ejemplo las piedras ruedan siempre cuesta abajo, nunca lo hacen hacía arriba.
En termodinámica se designa como energía dependiente de un alto grado de ordenamiento a la energía potencial, mientras que a la energía cinética molecular se la considera como energía con un grado reducido de ordenamiento. A medida, entonces, que la energía potencial se transforma en cinética, el desorden aumenta y utilizamos la expresión entropÍa, para caracterizar el grado de desorden de un sistema (las células NO están desordenadas, así que tienen baja entropía).
En la naturaleza, el desorden es un estado más probable que el orden y la entropía, como medida del desorden, se convierte en una función que tiende a crecer constantemente.
Sabemos que el contenido de energía potencial de los compuestos químicos está representados por la fuerza que mantiene unidos a los átomos y moléculas y cuando las sustancias químicas reaccionan, parte de esta energía se libera como calor y otra parte puede ser convertida en trabajo. Esta fracción de energía disponible para el trabajo se denomina energÍa libre o entalpÍa. En otras palabras es el monto máximo de trabajo que puede obtenerse de un sistema.
La energía libre: un criterio para cambio espontaneo
Los organismos solamente pueden vivir a expensas de la energía libre adquirida del entorno.
La cantidad de energía libre de un sistema se simboliza con la letra G. Hay dos componentes para G: la energía total del sistema (H) y su entropía (S). La energía libre se relaciona con estos factores de la siguiente manera:
G = H - TS
con T (temperatura, en grados Kelvin) para temperaturas absolutas. Como se ve, la temperatura aumenta el término de la entropía en la ecuación. Esto tiene sentido si se recuerda que la temperatura mide la intensidad del movimiento de las moléculas al azar (calor), lo que provoca desorden. Entonces, esta ecuación enuncia que no toda la energía almacenada en un sistema (H) está disponible para el trabajo. El desorden del sistema, el factor de entropía (S), se resta a la energía total para calcular la máxima capacidad del sistema para realizar trabajo útil.
¿Cómo el concepto de energía libre ayuda a determinar si un proceso determinado puede ocurrir espontáneamente? En la ecuación de más arriba, la energía libre (G) es considerada como una medida de inestabilidad del sistema, o sea su tendencia a cambiar a un estado más estable. Por lo tanto, aquellos sistemas que tienden a cambiar espontáneamente a uno más estable son los que tienen mayor energía, baja entropía o ambos. La ecuación de G considera estos dos factores los cuales están consolidados en el contenido de G del sistema en estudio. Ahora se puede establecer un criterio para cambio espontáneo: en cualquier proceso espontáneo la energía libre de un sistema decrece.
Los
cambios de energía libre cuando un sistema va desde un estado inicial
a un estado final es representado por ![]() :
:
![]() = G estado
final - G estado inicial
= G estado
final - G estado inicial
o, también:
![]()
Finalmente, para que un proceso
ocurra espontáneamente, el sistema debe ceder energía (decrece H) o
perder orden (se incrementa S), o ambos. Cuando los cambios en H o en
S son grandes, ![]() tiene un valor negativo.
tiene un valor negativo.
Las reacciones metabÓlicas son exergÓnicas o endergÓnicas
Las reacciones metabólicas pueden ser clasificadas en exergónicas (aquellas que liberan energía) o endergónicas (aquellas que consumen energía) tomando en cuenta sus cambios de energía libre.
En una reacción exergónica hay
una liberación neta de energía libre. Puesto que los reactantes pierden
energía libre (G), ![]() es negativa para una reacción exergónica. En otras palabras, las reacciones
exergónicas ocurren espontáneamente.
es negativa para una reacción exergónica. En otras palabras, las reacciones
exergónicas ocurren espontáneamente.
Las reacciones endergónicas toman
G de su entorno. Esto se debe a que esta clase de reacciones almacenan
más energía libre (G) en las moléculas, por lo tanto ![]() es positivo. Tales reacciones
no son espontáneas.
es positivo. Tales reacciones
no son espontáneas.
De lo anterior, se concluye que si un proceso químico es exergónico en una dirección, entonces el proceso inverso debe ser endergónico.
Desequilibrio Metabólico: Clave de la vida
Las reacciones químicas del metabolismo son reversibles y podrían equilibrarse sólo en un medio aislado como un tubo de ensayo. En los sistemas químicos en equilibrio ?G es cero y sin energía libre no hay trabajo, por lo tanto una célula que ha alcanzado su equilibrio está muerta.
Este desequilibrio metabólico es una de las características que define a la vida y esto se mantiene gracias a que en las vías metabólicas los productos no se acumulan , siendo sutratos de otras reacciones y por lo tanto no alcanzándose nunca el equilibrio. Por ejemplo, durante la respiración celular, la glucosa y otros combustibles energéticos son degradados y el dioxido de carbono es eliminado al medio interno y luego expelido al exterior con lo cual la célula no alcanza nunca su equilibrio y continua trabajando. Este simple ejemplo nos sirve para comprender la importancia que reviste para los organismos vivos ser sistemas abiertos.
La molÉcula de ATP es responsable de la mayorÍa de los procesos de acoplamiento energÉtico en las cÉlulas
Como se recordará, una estrategia clave de la bioenergética es el acoplamiento energético, es decir el uso de un proceso exergónico para llevar a cabo uno endergónico.
El adenosín trifosfato (ATP),”la moneda de la célula”, transfiere la energía liberada por la ruptura de las uniones químicas en los procesos exergónicos hacia las reacciones endergónicas, es decir las reacciones que consumen energía.
La célula puede realizar tres clases principales de trabajo donde se requiere energía:
· Trabajo Mecánico: como el batido de cilias y flagelos, la contracción de las células musculares, el fluir del citoplasma dentro de la célula o el movimiento de los cromosomas durante la división celular.
· Trabajo de Transporte: el bombeo de sustancias e iones a través de la membrana en contra de la dirección del movimiento espontáneo.
· Trabajo Químico: El impulso de reacciones endergónicos, que no ocurrirían espontáneamente, como la síntesis de los polímeros a partir de sus monómeros.
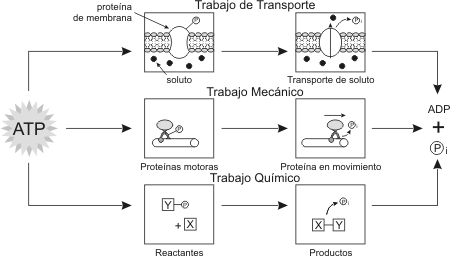
Fig. 3.2 - Tipos de trabajo celular que utilizan ATP
En la mayoría de los casos, la fuente inmediata de energía que potencia el trabajo celular es el ATP.
Esta molécula es también conocida como un transportador o intermediario energético.
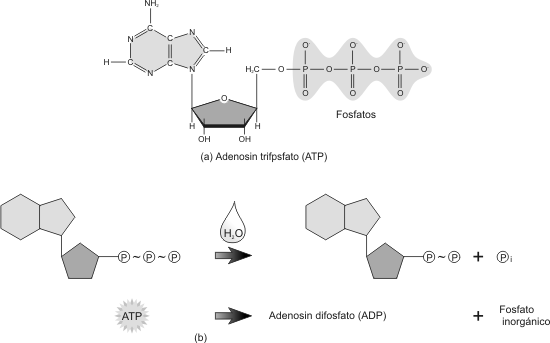
Fig. 3.3 - Molécula de ATP. (a) Estructura del ATP. (b) Hidrólisis de la molécula de ATP
El enlace entre el segundo y el tercer fosfato es un enlace rico en energía. Para establecerlo se necesitó de un gran aporte energético, esto es, de la energía libre obtenida del entorno por la célula.
Por otro lado, su ruptura resulta en la liberación de esta energía, la que puede ser empleada para los distintos tipos de trabajos celulares.
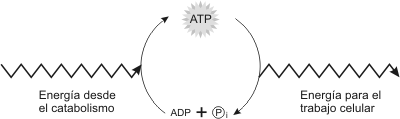
Fig. 3.4 - El ciclo del ATP. La energía liberada en las reacciones catabólicas se usan para fosforilar ADP, generando ATP. La energía almacenada en el ATP se utiliza en la mayoría de los trabajos celulares. Por lo tanto, el ATP acopla los procesos productores de energía de la célula a los consumidores de energía.
Muchos de las reacciones del metabolismos son reacciones de oxido-reducción
Los electrones poseen distintas cantidades de energía potencial según su distancia respecto del núcleo del átomo y la atracción del núcleo por los electrones. Al aportar energía, el electrón pasa a un nivel energético más alto, pero sin la energía adicional, el electrón permanece en el nivel energético más bajo disponible para él.
Las reacciones químicas son transformaciones energéticas en las cuales la energía almacenada en los enlaces químicos se transfiere a otros enlaces químicos recién formados. En estas transformaciones los electrones pasan de un nivel energético a otro. En muchas reacciones los electrones se transfieren de un átomo o molécula a otro. Estas reacciones muy importantes en los sistemas vivientes, se conocen como reacciones de oxidación-reducción (redox). La pérdida de un electrón se conoce como oxidación y el átomo o molécula que pierde el electrón se ha oxidado. La perdida de electrones se llama oxidación porque el oxígeno que atrae con fuerza a los electrones, es la mayoría de las veces el receptor de los mismos.
Reducción, por el contrario, es la ganancia de electrones. La oxidación y la reducción siempre ocurren simultáneamente, porque el electrón que pierde un átomo es aceptado por otro, que se ha reducido en el proceso.
En los sistemas vivientes muchas veces los electrones son transferidos con un protón, es decir, es un átomo de hidrógeno. En tal caso la oxidación implica una perdida de átomos de hidrógeno y la reducción la ganancia de estos.
La energÍa de las molÉculas es liberada en el transcurso de las reacciones de oxidaciÓn
Durante el transcurso de sucesivas y graduales reacciones de oxidación, la mayor parte de la energía química contenida en los alimentos es liberada de manera secuencial. De esta manera, se logra la eficaz captación de la energía liberada en enlaces de alta energía como los del ATP.
Como se ha dicho, toda oxidación de un átomo o de una molécula está asociada a la reducción de otro átomo u otra molécula. Durante las reacciones de oxidación pueden perderse hidrógenos (H). Estos se pueden disociar en un protón (H+) y en un electrón (e-). En un sentido general, toda remoción de e- de cualquier átomo o molécula constituye una reacción de oxidación. Este e- pudo haber sido removido de un H. Luego el H+ puede permanecer en la molécula a la que conformaba o puede pasar al medio.
Por otro lado, la reducción de un átomo o molécula puede implicar la ganancia de hidrógeno o e-.
Existen moléculas intermediarias en las reacciones de oxido-reducción: la nicotinamida adenina dinucleótido (NAD+), la nicotinamida adenina dinucleótido fosfato (NADP+) y la flavina adenina dinucleótido (FAD).
Las siglas de las coenzimas anteriormente expuestas representan las moléculas oxidadas. Las formas reducidas se representan: NADH + H+ ; NADPH + H+ ; FADH2 , respectivamente.
Por ejemplo, el compuesto XH2 es oxidado, NAD+ es reducido:
XH2 + NAD+ -> X+ + NADH + H+
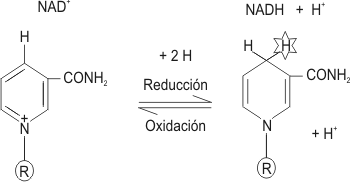
Fig. 3.5 - Oxido-reducción de la coenzima NAD+
ENZIMAS
IntroducciÓn
Todas las reacciones que se efectúan en los seres vivos son catalizadas por enzimas. Estas hacen posible que las reacciones metabólicas se desarrollen a un ritmo razonable, compatible con la vida.
El término catalizador se emplea para referirse a cualquier sustancia que acelera el transcurso de una reacción química, sin intervenir en ella ni como reactivo ni como producto. El catalizador no provoca la reacción solo afecta la velocidad con que ocurre la misma. Esto es posible por que los catalizadores disminuyen la energía de activación como lo indica el siguiente gráfico.
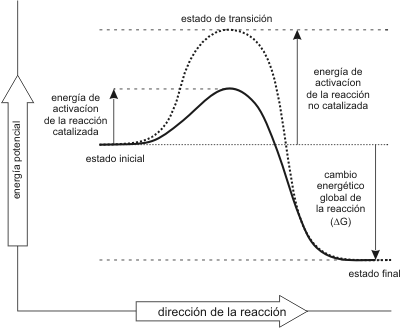
Fig. 3.6 - Perfil de energía de una reacción exergónica. La curva punteada indica el curso de la reacción sin enzima. La curva continua el curso de la reacción en presencia de la enzima
Según su naturaleza los catalizadores pueden ser químicos o biológicos (Tabla 3.1)
|
Tabla 3.1 - Diferencias entre catalizadores biológicos y químicos |
|
|
BiolÓgicos |
QuÍmicos |
|
Son específicos para una determinada reacción química o para un grupo de reacciones químicas a para un sustrato o grupo de sustratos. |
Aceleran cualquier reacción inespecíficamente. |
|
Son proteínas mayoritariamente ( hay ARN (Ribozimas) con función enzimática). |
Son sustancias simples finamente divididas. |
|
Son saturables |
No son saturables. |
|
Son altamente eficaces (son eficaces en bajas concentraciones). |
Son medianamente eficaces. |
|
Puede ser regulada su actividad catalítica. |
No pueden ser regulados. |
|
Son termolábiles y su actividad puede variar también de acuerdo al pH del medio. |
No son termolábiles ni se alteran con cambios de pH. |
Una enzima puede estar formada por una sola cadena de polipéptido, consistir en subunidades múltiples o requerir de componentes no proteicos. En general las reacciones catalizadas por enzimas se llevan a cabo a presión, temperatura y pH moderado.
ClasificaciÓn
Desde el punto de vista estructural podemos clasificar a las enzimas en simples y conjugadas (de la misma forma que hemos clasificado a las proteínas).
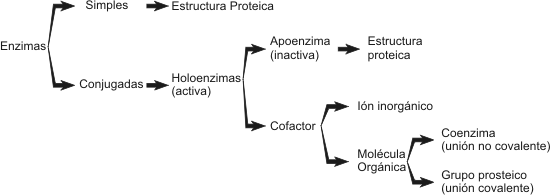
Cuadro 3.1 - Clasificación de las enzimas según su estructura
l Enzimas simples: son aquellas que constan solo de una estructura proteica. Pueden estar formadas por una o varias cadenas polipeptídicas.
Enzimas conjugadas: también llamadas holoenzimas poseen en su estructura una parte no proteica denominada cofactor y una parte proteica que se denomina apoenzima. Para que estas enzimas actúen como catalizadores es necesario que la apoenzima se una al cofactor. El término cofactor puede aplicarse tanto a un Ión como a una molécula orgánica de naturaleza variable (grupo prostético y coenzimas). Las coenzimas funcionan como portadores de grupos químicos pequeños como ser acetilo, metilo o bien protones y electrones. Las coenzimas se unen no covalentemente a la apoenzima permitiendo que la holoenzima así formada lleve a cabo reacciones que la apoenzima sola no puede efectuar. Por ejemplo, ninguna de las cadenas laterales de los aminoácidos es capaz de transportar electrones pero cuando se agrega por ejemplo la coenzima FAD+, la proteína adquiere esta función. Las moléculas orgánicas que están fuertemente unidas a la apoenzima se denominan grupos prostéticos. Muchas coenzimas derivan de vitaminas solubles en agua como ser las del grupo B (Tabla 3.2).
|
Tabla 3.2 - Vitaminas hidrosolubles , sus coenzimas derivadas y sus funciones |
|||
|
Vitamina |
Coenzima derivada |
Abreviatura |
Función |
|
Tiamina (B1) |
Pirofosfato de tiamina |
TPP |
Descarboxilación y transferencia de grupos acilo. |
|
Riboflavina (B2) |
Flavina mononucleótido |
FMN |
Portadores de hidrógeno y electrones en oxido-reducciones |
|
Flavina y adenina dinucleótido |
FAD |
||
|
Ácido Nicotínico |
Nicotinamida y adenina dinucleótido |
NAD+ |
Portadores de hidrógeno y electrones en oxido-reducciones |
|
Nicotinamida y adenina dinucleótido fosfato |
NADP+ |
||
|
Piridoxina, piridoxal y piridoxamina (B6) |
Transaminación y decarboxilación |
||
|
Ácido Pantoténico |
Coenzima A |
CoASH |
Transferencia de acilos |
|
Biotina |
Enlazada covalentemente a carboxilasas |
Carboxilación |
|
|
Ácido Fólico |
Tetrahidrofolato |
TH4 |
Transferencia de un carbono |
|
Cobalamina (B12) |
Coenzima de cobamida |
Reordenamientos, transferencia de metilos |
|
Otra forma de clasificarlas es de acuerdo con las reacciones que catalizan, como se indica en la Tabla 3.3, a continuación.
|
Tabla 3.3 - Clasificación de las Enzimas (según International Union of Biochemestry) |
|
|
Clase |
Tipo de reacción catalizada |
|
1 - Oxidorreductasas |
Síntesis de componentes a tráves de la ruptura oxidativa o reductora de un enlace de alta energía. p. ej. alcohol deshidrogenasa alcohol + NAD+ -> colina + glutamato |
|
2 - Transferasas |
Transferencia de un grupo funcional de una molécula a otra. p. ej. aspartato aminotransferasa L-aspartato + 2-oxoglutarato -> 2- oxalacetato + 1-L-glutamato |
|
3 - Hidrolasas |
Ruptura de enlaces por hidrólisis p. ej. Acetilcolina + H2O -> 2 oxalacetato + L- glutamato |
|
4 - Liasas |
Ruptura de enlaces por eliminación p. ej. Piruvato descarboxilasa 2 oxoácido -> aldehído + CO2 |
|
5 - Isomerasas |
Modificación de la forma o del ordenamiento espacial de las moléculas . p. ej. Fosfoglicerato mutasa 2-fosfoglicerato -> 3- fosfoglicerato |
|
6 - Ligasas |
Unión de moléculas usando la energía que se deriva de la hidrólisis de los enlaces de alta energía p. ej. Acetil- CoA ligasa ATP + acetato+ CoA -> AMP + acetato + CoA + pirofosfato + acetil-CoA |
Sitio activo
Es el sitio en el cual el o los sustratos se unen a la enzima. En general estos sitios se encuentran en el interior de la estructura proteica, formando hendiduras o bolsas, de manera que el sustrato pueda experimentar un máximo de interacciones con la enzima. De toda la estructura de la enzima, que en realidad son moléculas enormes, solo una parte muy pequeña interactúa con el sustrato en general solo participar cinco o seis aminoácidos.
La especificidad de una enzima hacia su sustrato es una de las características más notables, normalmente se propone el modelo de llave y cerradura para explicar la forma complementaria en que interactúan la enzima y el sustrato, sin embargo esto nos hace pensar en una estructura rígida. Actualmente se sabe que las enzimas son moléculas flexibles, por lo tanto el modelo más correcto sería el llamado ajuste o encaje inducido, en donde el sitio activo se modifica para hacerse complementario al sustrato. Una manera de graficar este modelo sería la forma en que un guante se ajusta a la mano, es decir el guante tiene una forma particular, que al momento de “interactuar” con la mano se modifica, haciéndose complementaria con la misma.
Mecanismo de acciÓn
Como hemos visto las propiedades químicas de una enzima dependen casi enteramente de las cadenas laterales. La actividad catalítica de una enzima resulta de la unión de la molécula de sustrato al sitio activo de la enzima por medio de interacciones generalmente débiles. Al parecer, las más significativas son las interacciones puente hidrógeno. También debemos recordar que esta unión es sumamente específica.
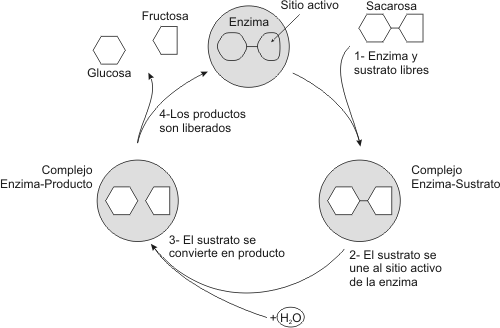
Fig. 3.7 - Ciclo catalítico de una enzima
Una vez que la enzima reconoce al sustrato y se ajusta a él, se forma un complejo que recibe el nombre de complejo enzima-sustrato. La ruptura y la formación de los enlaces se llevan a cabo por las interacciones entre las cadenas laterales de la enzima y los enlaces dentro del sustrato. Una vez que se han formado los productos obtenemos un complejo que recibe el nombre de complejo enzima–producto, finalmente los productos se separarán de la enzima recuperándose esta para reaccionar con otra molécula de sustrato, es decir que en el transcurso de la reacción la enzima no se modifica.
Factores que modifican la velocidad de las reacciones químicas
Una determinada reacción química ocurre solo en condiciones termodinámicas favorables, esto es cuando la energía de los reactivos o sustratos es mayor que la energía de los productos. La velocidad con que dicha reacción ocurrirá depende de distintos factores como ser la cantidad de reactivo o sustrato que interviene, la temperatura, el pH, etc.
Como hemos mencionado, las enzimas aumentan la velocidad de las reacciones químicas, sin embargo no las provocan, por lo tanto la concentración de enzimas es otro de los factores que modifican la velocidad de la reacción así como también aquellas sustancias que pueden inhibir la acción de la enzima (inhibidores).
1. Concentración de sustrato
En general a medida que aumenta la cantidad de reactivos o sustratos la velocidad también aumenta. En el caso de las reacciones químicas conviene aclarar que la velocidad se mide como cantidad de producto formado por unidad de tiempo, las unidades serán: gr/seg, moles/seg, moles/min, etc. De este modo cuanto más reactivo tenemos, más producto se formará.
En el caso de las reacciones catalizadas por enzimas, el efecto de la cantidad de sustrato es el siguiente:
A medida que aumenta la cantidad de sustrato la velocidad aumenta en forma lineal (zona proporcional), luego si bien la velocidad continúa aumentando ya no lo hace en forma lineal (zona mixta) hasta que finalmente la reacción alcanza una velocidad máxima que es constante, se vuelve independiente de la cantidad de sustrato (zona de saturación). Esto ocurre debido a que los sitios activos de las enzimas se encuentran todos interactuando con las moléculas de sustrato, por lo tanto hasta que no finalice la reacción la enzima no puede unirse a otro sustrato.
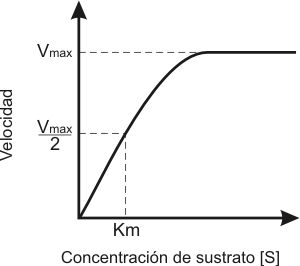
Fig. 3.8 - Efecto de la concentración de sustrato sobre la cinética enzimática
2. Concentración de enzimas
La concentración de enzimas es otro de los factores que modifica la velocidad, cuanto mayor cantidad de enzima este presente, mayor será la velocidad que se alcanzará, debido a que necesito más cantidad de sustrato para alcanzar la saturación.
3. Temperatura
En general las reacciones ocurren más rápidamente cuando se le otorga calor, ya que el aumento de la temperatura hace que aumente la energía cinética de las moléculas y de esta manera reaccionen con facilidad.
Cuando las reacciones están catalizadas por enzimas se produce primero un efecto complementario, es decir, la velocidad va aumentando conforme al aumento de temperatura, sin embargo la velocidad llega a un punto óptimo a partir del cual la velocidad comienza a decaer. No nos olvidemos que las enzimas son proteínas, por lo tanto son susceptibles a la desnaturalización, es decir que la velocidad decae porque las enzimas pierden su actividad biológica como consecuencia de la desnaturalización. Algunas enzimas son termoestables, es decir su actividad biológica permanece aun a temperaturas mayores a 90 °C.
4. pH
El gráfico de actividad en función del pH es similar al de la temperatura, es decir a pH extremos las proteínas se desnaturalizan, por lo tanto la actividad biológica decae. Algunas enzimas no varían su actividad con el pH sino que esta se mantiene constante en un amplio rango. Otra tendrán el pH óptimo ácido o básico teniendo en cuenta el medio en donde actúan.
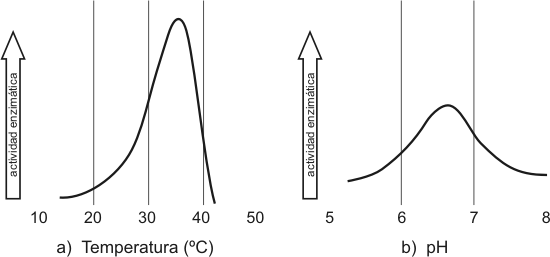
Fig. 3.9 - Efecto de la temperatura (a) y el pH (b) sobre la actividad enzimática
5. Inhibidores
Aunque hay muchos ejemplos de inhibidores, los mecanismos de inhibición pueden ser de dos clases: reversibles e irreversibles, también hay mecanismos intermedios.
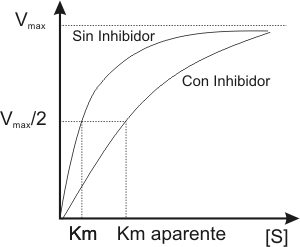
Fig. 3.10 - Perfil de una reacción en presencia de inhibidor
COMPETITIVO y sin inhibidor
5.1. Inhibidores irreversibles: estos inhibidores se enlazan con fuerza a la enzima, generalmente se unen covalentemente a algún aminoácido del sitio activo. Existen algunos inhibidores que se conocen como sustrato suicida, que se enlazan al centro activo y químicamente se transforma en una especie reactiva que modifica en forma irreversible al aminoácido del sitio activo.
5.2. Inhibidores reversibles: este tipo de inhibidores se disocian fácilmente de las enzimas, dentro de este grupo encontramos los inhibidores competitivos y los no competitivos.
5.2.a. Los inhibidores competitivos compiten con el sustrato por el sitio activo de la enzima, y si aumentamos la cantidad de sustrato, el efecto inhibidor se revierte alcanzándose la velocidad máxima.
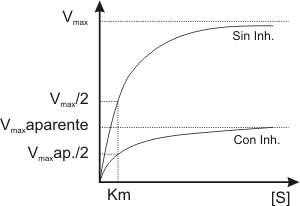
Fig. 3.11 - Perfil de una reacción en presencia de inhibidor NO COMPETITIVO y sin inhibidor
5.2.b. Los inhibidores no competitivos se enlazan a un sitio distinto del sitio activo, de manera que el inhibidor se puede unir a la enzima libre o bien al complejo enzima sustrato, pero en ninguno de los casos obtendremos productos. El efecto de estos inhibidores no se revierte por el agregado de mayor cantidad de sustrato, de manera que se llega a una velocidad máxima menor que si no tuviera el inhibidor.
No es raro observar algunos inhibidores a los cuales no se les puede comprobar el mecanismo exacto de inhibición, siendo en algunos casos un tipo de inhibición mixta.
RegulaciÓn de la actividad enzimÁtica
Dentro de las células se llevan a cabo infinidad de procesos metabólicos, todos ellos relacionados entre sí, de manera que deben estar controlados en forma precisa, para que a cada instante la célula disponga de los metabolitos necesarios para su funcionamiento. Para lograr esta coordinación metabólica es preciso disponer de mecanismos de control o regulación adecuados.
Existen distinto tipos de mecanismos regulatorios de la actividad enzimática:
1. Inhibición por producto final
2. Regulación alostérica
3. Regulación por modificación covalente
4. Regulación genética
1. Inhibición por producto final: Con frecuencia las enzimas son inhibidas en forma competitiva por los productos de las reacciones que catalizan. Esto es predecible, ya que la estructura del producto es muy similar a la del sustrato. Esta inhibición ocurre en las últimas etapas de la reacción cuando hay una gran cantidad de producto y baja concentración de reactivo o sustrato. En la mayoría de los casos, las reacciones metabólicas no ocurren en un solo paso, sino que son varias y encadenadas formando parte de una ruta metabólica, en donde el producto de una reacción es el sustrato de la siguiente. Generalmente en estos casos el producto final, es decir el producto de la última reacción de esa vía, actúa inhibiendo a las enzimas que intervienen en los primeros pasos.
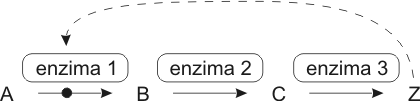
Fig. 3. 12 - Retroalimentación negativa (feedback negativo) en una ruta metabólica. Cuando el producto final Z se acumula, inhibe alguno de los primeros pasos de la ruta.
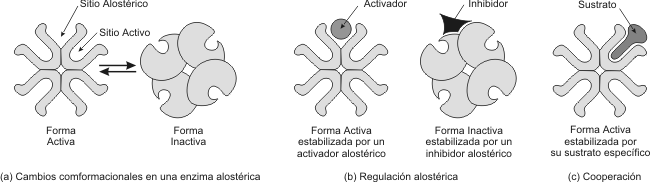
Fig. 3.13 - Regulación alostérica. (a) La mayoría de las enzimas alostéricas se ensamblan a partir de 2 o más subunidades. Cada una posee un sitio activo. La enzima oscila entre dos estados: activo e inactivo. Alejado del sitio activo esta el sitio alostérico, que actúa como un receptor específico regulando la actividad enzimatica. (b) Se observa el efecto opuesto de un activador y un inhibidor sobre las cuatro subunidades de la enzima. (c) Efecto de cooperación: un sustrato unido a uno sólo de los sitios activos (encaje inducido), puede activar toda la enzima.
2. Regulación alostérica: Este tipo de regulación ocurre solo en las enzimas alostéricas, que son enzimas que por lo general tienen estructura cuaternaria y además del sitio activo poseen otro capaz de reconocer efectores, que se denomina sitio alostérico. Los efectores son sustancias que pueden modular la actividad de las enzimas, algunos efectores aumentan la actividad enzimática, de modo que se conocen como efectores positivos y otros tienen efecto inhibitorio que se denominan efectores negativos.
Las enzimas alostéricas presentan curvas de saturación del sustrato distintas a lo que vimos anteriormente, dan una curva sigmoidea en lugar de una hipérbola (Fig. 3.14).
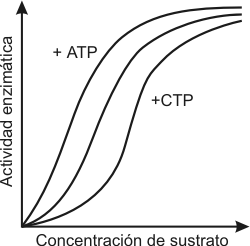
Fig.
3.14 - Curva de saturación de una enzima alostérica.
Como otro ejemplo de este tipo de regulación, podemos mencionar la enzima fosfofructoquinasa que cataliza la siguiente reacción:
FRUCTOSA 6 FOSFATO + ATP -> ADP + FRUCTOSA 1,6 DI-FOSFATO
El ATP es un modulador negativo, es decir que disminuye la actividad de la enzima , mientras que el AMP y el P son moduladores positivos
3. Regulación por modificación covalente: en este mecanismo algún aminoácido de la enzima se une covalentemente a algún grupo químico y de esta forma se activa o se inactiva la enzima. El grupo que más frecuentemente interviene en este tipo de regulación es el grupo fosfato (P) y los aminoácidos que normalmente intervienen son la serina y la treonina.
Algunas enzimas se activan al unirse al grupo fosfato y se inactivan si lo pierden
Enzima
A (inactiva) + P ![]() Enzima A + P (activa)
Enzima A + P (activa)
Otras se activan al perder el grupo P y se inactivan al ganarlo
Enzima
B ~ P (inactiva) ![]() Enzima
B (activa) + P
Enzima
B (activa) + P
El ejemplo más característico lo constituyen las enzimas que intervienen en la síntesis y degradación de glucógeno.
Proteína quinasa ~P
(inactiva) ![]() Proteína quinasa
(activa) + P
Proteína quinasa
(activa) + P
Fosforilquinasa (inactiva)
![]() Fosforilasa quinasa ~P (activa)
Fosforilasa quinasa ~P (activa)
Fosforilasa (inactiva)
![]() Fosforilasa ~ P (activa)
Fosforilasa ~ P (activa)
Glucógeno
![]() Glucosa
Glucosa
4. Regulación genética: Involucra el control a nivel del ADN. El ADN es la molécula que almacena la información para la síntesis de proteínas de acuerdo al siguiente flujo de información:
![]()
Fig. 3.15 - Flujo de la información genética
De manera que si podemos impedir el pasaje de ADN a ARN (transcripción) impedimos la síntesis de la enzima y por ende no se catalizará la reacción en la que dicha enzima interviene.
El ARN como catalizador biolÓgico
Hasta hace poco tiempo se suponía que los catalizadores biológicos siempre eran proteínas. Recientemente se demostró que el ARN puede actuar como catalizador en el corte y empalme de intrones (proceso que veremos en otro capítulo). Además se ha demostrado que la especie de ARN llamado ARN L19 posee todas las propiedades características de las enzimas, tales como la saturación, inhibición competitiva, especificidad de sustrato, etc., con la excepción de que no es una proteína. Estos ARN catalíticos reciben el nombre de ribozimas.
actividades de autoevaluaciÓn
1. ¿Qué es una enzima? ¿Cuál es su importancia biológica?
2. ¿Qué tipos de catalizadores conoce?
3. ¿Qué es una ribozima?
4. Mencione y explique brevemente los mecanismos de regulación enzimática.
Preguntas de opciÓn mÚltiple
1. La temperatura:
a. aumenta el efecto catalítico de las enzimas siempre
b. disminuye el efecto catalítico de las enzimas siempre
c. aumenta el efecto hasta alcanzar un máximo a temperatura ambiente
d. disminuye la acción catalítica a partir de los 80° C
e. ninguna es correcta.
2. Una enzima alostérica:
a. se puede regular
b. no se puede regular
c. aumenta su efecto catalítico al unirse a un efector positivo
d. a y c son correctas
e. b y c son correctas
3. Un inhibidor competitivo:
a. siempre se une al sitio alostérico
b. se une al sitio activo
c. es parecido al sustrato
d. a y c son correctas
e. b y c son correctas.
4. Un cofactor es:
a. una molécula orgánica que aumenta el efecto catalítico
b. una molécula orgánica que disminuye el efecto catalítico
c. una molécula inorgánica que se une covalentemente a la enzima
d. una molécula necesaria para que la apoenzima actúe
e. ninguna es correcta
5. Las enzimas son:
a. específicas
b. saturables
c. termolábiles
d. regulables
e. todas son correctas
6. Un grupo prostético:
a. es una secuencia de aminoácidos que forman parte del sitio activo.
b. forma parte de la estructura de ciertas enzimas, pudiendo disociarse de ellas fácilmente.
c. es un grupo químico no protéico unido covalentemente a ciertas enzimas y proteínas.
d. es la parte protéica de una holoenzima.
7. La formación del complejo enzima-sustrato:
a. implica necesariamente la unión covalente del sustrato al sitio activo de la enzima.
b. se lleva a cabo mediante interacciones débiles entre el sustrato y el sitio de unión de la enzima.
c. es un proceso irreversible, que conduce indefectiblemente a la formación del producto.
d. es bloqueada por los inhibidores competitivos, aún frente a altas concentraciones del sustrato.
8. El FAD y el FMN son:
a. grupos prostéticos característicos de los citrocromos
b. cofactores enzimáticos metálicos
c. coenzimas derivadas de la riboflavina
d. holoenzimas
9. La hidrólisis del ATP para dar ADP + Pi es :
a. una reacción no espontánea
b. una reacción endergónica
c. posible acoplarla a las reacciones exergónicas
d. una reacción exergónica
10. ¿Cuál de las siguientes afirmaciones no es cierta acerca de las conversiones energéticas?
a. Algo de energía útil siempre se disipa hacia el entorno como calor.
b. La energía total de un sistema y su entorno permanece constante.
c. Las reacciones exergónicas se llevan a cabo espontáneamente.
d. El energía potencial de un sistema siempre permanece constante después de una conversión energética.
e. Las reacciones exergónicas usualmente resulta en un estado final que tiene menos energía potencial que el estado inicial.
11. Las reacciones que requieren consumo de energía se conocen como:
a. endergónicas
b. exergónicas
c. exotérmicas
d. reductiva
e. oxidativas
12. Todas las reacciones que ocurren espontáneamente se llaman:
a. exergónicas
b. oxidativa
c. exotérmica
d. reductiva
e. endergónica
13. La medida de azarocidad o desorden en un sistema se conoce como:
a. calor.
b. entropía
c. el cambio en la energía libre.
d. entalpía
e. calor específico
14. ¿En cuál situación la entropía no se incrementaría?
a. Un cubito de hielo derritiéndose.
b. Algunas plantas muriéndose debido a la falta de agua.
c. Algo de sal disolviéndose en agua.
d. Agua hirviendo evaporándose.
e. Un grupo de plantas produciéndo glucosa.
BibliografÍa
l Alberts, B et al. (1996) Biología Molecular de la Célula. 3ra Edición. Ediciones Omega S.A.Barcelona.
l Campbell, N. (1997) Biology. 4th Edition. the Benjamin Cummings Publishing Company. Inc. California.
l Curtis y Barnes (1992). Biología. 5ª Ed. Bs.As. Editorial Médica Panamericana.
l Harper, (1995) Manual de Bioquímica. Ediciones El Manual Moderno. México.
l Karp, G.. (1998) Biología Celular y Molecular. Ed. Mc Graw Hill Interamericana. México.
l Kuchel,p y Ralston, G. (1994) Bioquímica General. Serie Schaum. Ed. McGraw-Hill. México.
l Smith and Wood. (1998) . Moléculas Biológicas. Ed.Addison-Wesley. Iberoamericana S.A.
l Solomon y col. (1998) . Biología de Villee. 4ª. Ed.McGraw-Hill. Interamericana. México.
l
Stryer, L.. (1995) Bioquímica. Ed. Reverté. España.